题目内容
4.设NA为阿伏伽德罗常数的值.下列有关叙述不正确的是( )| A. | 44g乙醛与乙酸乙酯的混合物中含氧原子数为NA | |
| B. | 40gH2${\;}_{\;}^{18}$O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 62gNa2O与78gNa2O2所含的阴离子数均为NA |
分析 A.乙醛和乙酸乙酯的最简式都是C2H4O,根据最简式计算出二者的混合物中含有的氧原子数目;
B.质量转化为物质的量,结合H2${\;}_{\;}^{18}$O含有10个中子,D2O含有10个中子解答;
C.铁与稀硫酸反应生成二价铁,与稀硝酸反应生成三价铁;
D.质量转化为物质的量结合过氧化钠阴离子为过氧根离子解答.
解答 解:A.44g乙醛和乙酸乙酯的混合物中含有1mol最简式C2H4O,含有1mol碳原子,含有的碳原子数目为NA,故A正确;
B.H2${\;}_{\;}^{18}$O含有10个中子,D2O含有10个中子,H2${\;}_{\;}^{18}$O与D2O摩尔质量相等都是20g/mol,40gH2${\;}_{\;}^{18}$O与40gD2O物质的量为$\frac{40g}{20g/mol}$=2mol,含有中子数为20NA,故B正确;
C.1molFe与足量的稀硫酸反应生成1mol硫酸亚铁,转移2NA电子,与足量稀硝酸反应生成1mol硝酸铁,转移电子数均为3NA,故C错误;
D.62gNa2O物质的量为$\frac{62g}{62g/mol}$=1mol,含有1mol氧离子,78gNa2O2物质的量为$\frac{78g}{78g/mol}$=1mol,含的阴离子过氧根离子数均为1mol,故D正确;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠中阴离子为过氧根离子,题目难度不大.

练习册系列答案
相关题目
19.下列化学反应中,属于氧化还原反应( )
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
20.木炭屑与HNO3共热产生的气体等分为①和②两份,第①份先导入适量蒸馏水,再导入石灰水,第②份直接导入石灰水.则石灰水的变化可能是( )
| A. | ①不变浑浊,②变浑浊 | B. | ①变浑浊,②不变浑浊 | ||
| C. | ①变浑浊,②变浑浊 | D. | ①不变浑浊,②变浅黄色 |
17.鉴别二氧化氮和溴蒸气较为合适的试剂是( )
| A. | 湿润的蓝色石蕊试纸 | B. | 硝酸银溶液 | ||
| C. | 氢氧化钠溶液 | D. | 淀粉碘化钾溶液 |
13.鉴别SO42-时所选用的试剂及顺序最合理的是( )
| A. | 稀盐酸、BaCl2溶液 | B. | 稀硝酸、BaCl2溶液 | ||
| C. | Ba(NO3)2溶液、稀盐酸 | D. | BaCl2溶液、稀盐酸 |
14.下列物质中,属于电解质的是( )
| A. | SO2 | B. | Cl2 | C. | BaSO4 | D. | 稀硫酸 |
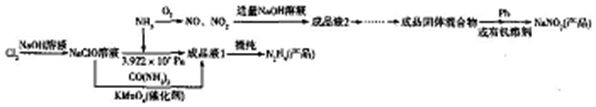


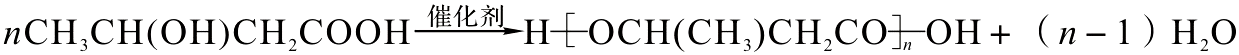 .
.