题目内容
17.鉴别二氧化氮和溴蒸气较为合适的试剂是( )| A. | 湿润的蓝色石蕊试纸 | B. | 硝酸银溶液 | ||
| C. | 氢氧化钠溶液 | D. | 淀粉碘化钾溶液 |
分析 均为红棕色,均具有氧化性,但溶于水颜色不同,且二氧化氮使湿润的蓝色石蕊试纸先变红后褪色、溴与硝酸银反应生成浅黄色沉淀,以此来解答.
解答 解:A.二氧化氮使湿润的蓝色石蕊试纸先变红后褪色,溴使湿润的蓝色石蕊试纸变红,现象不同,且操作简单,故A选;
B.溴与硝酸银反应生成浅黄色沉淀,二氧化氮与水反应后溶液为无色,可鉴别,故B选;
C.均与NaOH反应后,溶液为无色,现象相同,不能鉴别,故C不选;
D.均可氧化KI,则淀粉KI溶液变蓝,现象相同,不能鉴别,故D不选;
故选AB.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
8.常温下,200mL0.5mol/L硫酸溶液的pH是( )
| A. | 0 | B. | 1 | C. | 2 | D. | 0.1 |
5.关于硝酸的叙述不正确的是( )
| A. | 浓硝酸与浓盐酸一样,在空气中出现白雾 | |
| B. | 硝酸见光分解和受热分解产物相同,都是NO2、O2、H2O | |
| C. | NO2和水反应有HNO3生成,所以NO2是硝酐 | |
| D. | 硝酸与金属反应,既表现出氧化性,又表现出酸性 |
12.碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等,工业上用水合肼(N2H4•H2O)还原法制取碘化钠固体,其制备流程如图所示:
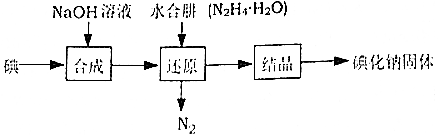
已知:N2H4•H2O在100℃以上分解
(1)在合成NaI的过程中,可能混有的物质是NaIO3,生产过程中要适当补充NaOH,目的是促使反应向生成物方向移动;
(2)在还原过程中,为了防止水合肼(N2H4•H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是温度过低,降低化学反应速率,工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是N2H4•H2O的氧化产物为N2和H2O,不引入杂质;
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-[可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液]
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品并溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol•L-1的Na2SO4溶液滴定至终点(发生反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
①在滴定过程中,Na2S2O3溶液应放碱式滴定管(填仪器)中,加入的A物质为淀粉(填名称);
②滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复;
③该样品中NaI的含量为90%;
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是部分NaI被空气中O2氧化;
(5)碘化钠固体的保存方法是用棕色瓶遮光、密封保存.

已知:N2H4•H2O在100℃以上分解
(1)在合成NaI的过程中,可能混有的物质是NaIO3,生产过程中要适当补充NaOH,目的是促使反应向生成物方向移动;
(2)在还原过程中,为了防止水合肼(N2H4•H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是温度过低,降低化学反应速率,工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是N2H4•H2O的氧化产物为N2和H2O,不引入杂质;
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-[可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液]
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品并溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol•L-1的Na2SO4溶液滴定至终点(发生反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
②滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复;
③该样品中NaI的含量为90%;
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是部分NaI被空气中O2氧化;
(5)碘化钠固体的保存方法是用棕色瓶遮光、密封保存.
4.设NA为阿伏伽德罗常数的值.下列有关叙述不正确的是( )
| A. | 44g乙醛与乙酸乙酯的混合物中含氧原子数为NA | |
| B. | 40gH2${\;}_{\;}^{18}$O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 62gNa2O与78gNa2O2所含的阴离子数均为NA |
1.给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl2$\stackrel{Cu}{→}$Fe | |
| C. | FeS2$\stackrel{O_{2}/高温}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO$\stackrel{H_{2}O}{→}$HNO3 |
2.一张浸润了溴水的滤纸,挂在盛有SO2的集气瓶中,它由黄色变为无色的原因是( )
| A. | 溴被SO2还原为无色的离子 | B. | SO2与Br2化合为一种无色的化合物 | ||
| C. | 反应放热,使溴挥发 | D. | SO2漂白了滤纸 |