题目内容
3.在25℃、101kPa下,依据事实,写出下列反应的热化学方程式.(1)1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1.
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1.
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1
(4)已知:下列两个热化学方程式:
Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H=-272.0kJ/mol
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1675.7kJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
(5)已知热化学方程式:
①C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H1=-1301.0kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2(g)的△H为+228.2 KJ/mol
(6)已知:
CH4 (g)+2O2(g)═CO2 (g)+2H2 O (l)△H=-Q1 kJ•mol-1
2H2(g)+O2(g)═2H2 O (g)△H=-Q2 kJ•mol-1
2H2(g)+O2(g)═2H2 O (l)△H=-Q3 kJ•mol-1
取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为0.4Q1+0.05Q3.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ;
(2)根据每生成23gNO2即0.5molNO2需要吸收16.95kJ热量,结合热化学方程式的书写方法结合热化学方程式的意义来回答;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(4)依据题干热化学方程式结合盖斯定律写出该热化学反应方程式;
(5)利用盖斯定律,将②×2+③-①即得到反应④,反应热为△H=2△H2+△H3-△H1,以此解答该题;
(6)根据混合气体的体积计算混合气体的物质的量,标准状况下Vm=22.4L/mol,根据n=$\frac{V}{{V}_{m}}$结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量.
解答 解:(1)1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,即1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
(2)适量的N2和O2完全反应,每生成23克NO2即0.5molNO2要吸收16.95kJ热量,所以每生成2molNO2需要吸收67.8kJ热量,则热化学方程式为:
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(4)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1;
(5)根据盖斯定律可知,②×2+③-①即得到反应④2C(s)+H2(g)═C2H2(g),所以该反应的△H=-393.5 kJ•mol-1×2-285.8 kJ•mol-1+1301.0 kJ•mol-1=+228.2 kJ•mol-1,
故答案为:+228.2 KJ/mol;
(6)n(混合气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
由此可得,n(CH4)=0.5mol×$\frac{4}{5}$=0.4mol、n(H2)=0.5mol×$\frac{1}{5}$=0.1mol,
氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1kJ/mol可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)═2H2O(l)△H=-Q3kJ/mol可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×$\frac{1}{2}$×Q3kJ/mol=0.05Q3kJ,所以放出的热量为0.4Q1+0.05Q3,
故答案为:0.4Q1+0.05Q3.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度中等,注意把握从键能的角度计算反应热的方法.

 备战中考寒假系列答案
备战中考寒假系列答案①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③验证某RX是碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液出现黑色沉淀
④向盛有新制的银氨溶液的试管中加入几滴乙醛后,未出现银镜
⑤铜丝加热后立即插入乙醇中反应制取乙醛.
| A. | ①④⑤ | B. | ①③④ | C. | ③④ | D. | ①②⑤ |
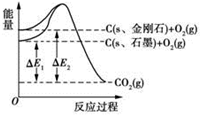 2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )| A. | 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量 | |
| B. | 石墨转化为金刚石属于物理变化 | |
| C. | 金刚石的稳定性强于石墨的 | |
| D. | 1 mol金刚石的能量大于1mol CO2的能量 |
| A. | 硒(Se)化氢比硫化氢稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 |
| A. | 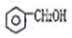 醇类-OH 醇类-OH | B. | CH3CH2COOH 羧酸类-COOH | ||
| C. | 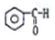 酮类-CHO 酮类-CHO | D. | CH3CH2Br 卤代烃类-Br |
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
| 滴定序号[来源:学科网] | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)滴定终点时的现象是浅红色变为无色,30S不变色.
(2)所配制的250mL样品液中NaOH的物质的量浓度是0.08 mol•L-1;试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
| A. | 放电时,正极电极反应是 Pb(s)+SO42-(aq)═PbSO4(s)+2e- | |
| B. | 放电时,电池的负极材料是铅板,负极质量增加 | |
| C. | 充电时,电池中硫酸的浓度始终保持不变 | |
| D. | 充电时,阳极发生的反应是 PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
| A. | 用量筒量取10.00mL溶液 | B. | 用酒精萃取碘水中的碘 | ||
| C. | 用托盘天平称取2.50g固体 | D. | 用分液漏斗分离乙酸乙酯和水 |