题目内容
14.若实验遇到下列情况.对所配氢氧化钠溶液的物质的量浓度有何影响(填偏高、偏低、无影响).(1)将氢氧化钠固体放在滤纸上进行称量偏低;
(2)未将洗涤液加入容量瓶偏低;
(3)定容时仰视刻度线偏低;
(4)摇匀后发现凹液面下降,又加蒸馏水至刻度线偏低;
(5)配制前容量瓶用水洗涤后未进行干燥处理无影响;
(6)氢氧化钠溶液未冷却至室温就转移到容最瓶偏高.
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响判断对物质的量浓度的影响,以此来解答.
解答 解:(1)将氢氧化钠固体放在滤纸上进行称量,NaOH的质量偏小,n偏小,由c=$\frac{n}{V}$可知,浓度偏低,故答案为:偏低;
(2)未将洗涤液加入容量瓶,n偏小,由c=$\frac{n}{V}$可知,浓度偏低,故答案为:偏低;
(3)定容时仰视刻度线,V偏大,由c=$\frac{n}{V}$可知,浓度偏低,故答案为:偏低;
(4)摇匀后发现凹液面下降,又加蒸馏水至刻度线,V偏大,由c=$\frac{n}{V}$可知,浓度偏低,故答案为:偏低;
(5)配制前容量瓶用水洗涤后未进行干燥处理,对实验无影响,故答案为:无影响;
(6)氢氧化钠溶液未冷却至室温就转移到容最瓶,V偏小,由c=$\frac{n}{V}$可知,浓度偏高,故答案为:偏高.
点评 本题考查配制一定浓度的溶液,为高频考点,把握物质的量、体积、浓度的关系为解答的关键,侧重分析与实验能力的考查,注意结合公式及操作分析误差,题目难度不大.

练习册系列答案
相关题目
2.下列电离方程式中,正确的是( )
| A. | NaOH=Na++OH- | B. | Na2SO4=2Na++SO4-2 | ||
| C. | H2SO4=H2++SO42- | D. | Ca(NO3)2=Ca2++2(NO3)2- |
9. 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )| A. | 1个晶胞中离子的总数为18 | |
| B. | X2+离子的配位数为8,Y2-离子的配位数为4 | |
| C. | 与每个X2+距离最近的X2+共有12个 | |
| D. | 该化合物的化学式为CaS |
6.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温下,1L 0.1mol/L HCl溶液中含氢原子数是0.1NA | |
| B. | 标准状况下,2.24L由CO2和O2组成的混合气体中含氧分子数是0.1NA | |
| C. | 10g碳酸钙与足量的稀盐酸充分反应消耗的氢离子数为0.1NA | |
| D. | 标准状况下,11.2L CO和 NO混合气体中与11.2LN2中分子数均为0.5NA |
3.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A. | 两种气体的压强相等 | B. | O2和O3的原子个数相等 | ||
| C. | 两种气体的氧化能力相同 | D. | 两种气体的分子数目相等 |
4.含有一个双键的烯烃和H2加成后的产物结构如图,则该烯烃的可能结构有( )种


| A. | 8 种 | B. | 7种 | C. | 6种 | D. | 5种 |

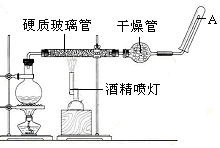 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.