题目内容
12.下列有关实验操作或说法正确的是( )| A. | 从试剂瓶中取出的任何药品,若药品有剩余都不能再放回原试剂瓶中 | |
| B. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| C. | 用蒸发的方法,除去酒精溶液中少量的水分 | |
| D. | 用托盘天平称量25.20gNaCl |
分析 A.一般情况下从试剂瓶中取出的药品不能放回原试剂瓶,但等于贵重样品钠、钾等,对原试剂没有污染的试剂,可放回原瓶;
B.铝和氢氧化钠溶液反应生成可溶性的盐,铁和氢氧化钠溶液不反应;
C.酒精与水为互溶液体;
D.天平可精确到0.1g.
解答 解:A.并不是所有的试剂用完后不能放回试剂瓶,如钠、钾等对原试剂没有污染的药品,用剩的可放回原瓶,故A错误;
B.铝和氢氧化钠溶液反应生成可溶性的盐,铁和氢氧化钠溶液不反应,所以可以用氢氧化钠溶液除去铁粉中混有的铝粉,故B正确;
C.酒精与水为互溶液体,不能蒸发分离,应选择蒸馏法,故C错误;
D.天平可精确到0.1g,无法用托盘天平称取25.20g氯化钠,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,把握常见操作的原理、步骤、方法和注意事项,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.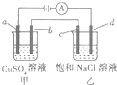 如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯中b电极反应式为:Cu2++2e-═Cu | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为0.56L(标准状况) |
20.25℃时,在浓度均为0.1mol•L-1的10mLHCl与CH3COOH混合溶液中,滴加0.1mol•L-1的NaOH溶液.下列有关溶液中粒子浓度关系正确的是( )
| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
7.硅是带来人类文明的重要元素之一,下列物质中主要成分是硅酸盐的是( )
| A. | 金刚石 | B. | 砖瓦 | C. | 水晶 | D. | 大理石 |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
4.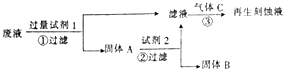 如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
 如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )| A. | 试剂1可以是铁也可以是铜 | |
| B. | 试剂2可以是盐酸也可以是硫酸 | |
| C. | 气体C为Cl2,不能用H2O2替换 | |
| D. | 步骤①②③中发生的反应均为氧化还原反应 |
1.下列关于Na2CO3和NaHCO3的说法中正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 澄清的石灰水能与Na2CO3反应,不与NaHCO3反应 | |
| D. | 等物质的量的Na2CO3和NaHCO3与等浓度足量的盐酸反应,消耗盐酸体积之比为2:1 |
2.下列实验操作或装置符合实验要求的是( )
| A. |  构成铜锌原电池 | B. |  电解制氢气、氯气 | ||
| C. |  中和反应热量测定 | D. |  酸碱中和滴定 |