题目内容
20.H2S溶于水的电离方程式为H2S?H++HS-、HS-?H++S2-.向H2S溶液中加入NaOH固体时,c(H+)减小,c(S2-)增大.(填增大、减小或不变)分析 H2S溶于水形成弱酸溶液,硫化氢为二元弱酸分步电离,当向H2S溶液中加入NaOH固体时,OH-与H+反应,硫化氢的电离平衡正移,c(S2-)增大,c(H+)减小.
解答 解:H2S溶于水形成弱酸溶液,硫化氢为二元弱酸分步电离,H2S?H++HS-、HS-?H++S2-,向H2S溶液中加入NaOH固体,氢氧化钠电离出氢氧根离子会和氢离子反应,促进电离平衡正向进行,氢离子浓度减小,硫离子浓度增大,
故答案为:H2S?H++HS-、HS-?H++S2-;减小;增大.
点评 本题考查了弱电解质H2S的电离及其影响因素等知识,明确电解质的相关概念、掌握影响弱电解质电离的因素是解本题关键,题目难度不大.

练习册系列答案
相关题目
9.常温下.下列关于电解质溶液的叙述中正确的是( )
| A. | 加水稀释时.在$\frac{c(O{H}^{-})}{C({H}^{+})}$的值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+ | |
| B. | 100℃时,将pH=2的硫酸溶液与pH=12的氢氧化钠溶液等体积混合,溶液显中性 | |
| C. | 25℃时,NaB溶液的pH=9,则c(Na+ )-c(B-)=9.9×10-6mol•L-1 | |
| D. | 将0.2mol•L-1 的一元弱酸HA溶液和0.1mol•L-1 的NaOH溶液等体积混合:2c(OH-)+c(A-)=2c(H+)+c(HA) |
11.80℃时,NO2(g)+SO2(g)?SO3(g)+NO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| C(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 平衡时,丙中SO2的转化率大于50% | |
| B. | 当反应平衡时,乙中c(NO2)是甲中的2倍 | |
| C. | 温度升至90℃,上述反应平衡常数为$\frac{25}{26}$,则Z正反应为吸热反应 | |
| D. | 其他条件不变,若起始时向容器乙中充入0.10mol•L-lNO2和0.20mol•L-lSO2,达到平衡时c(NO)与原平衡相同 |
5.下列说法正确的是( )
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
12.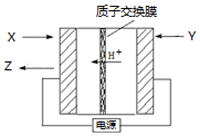 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | Y参与的电极反应为H2+2e-=2H+ | |
| B. | 反应过程中左边区域溶液pH逐渐升高 | |
| C. | 图中所示物质中,X为H2,Y为N2 | |
| D. | 当有3g H+通过质子交换膜时,Z的体积为22.4L |
9.关于如图所示各装置的叙述中,正确的是( )
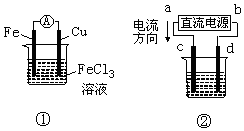

| A. | 装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 装置①中,铁做负极,该电极反应式为:Fe3++e-═Fe2+ | |
| C. | 装置②为铁上镀铜装置c为纯铜电极 | |
| D. | 若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
10.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |