题目内容
(验室通常用加热NH4Cl和Ca(OH)2混合物的方法来制取氨气.该反应的化学方程式为 ,收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂,如何检验氨气已经收集满 ,实验过程中如何防止多余的氨气污染空气 .
考点:氨的化学性质
专题:有机物的化学性质及推断
分析:固体氯化铵和氢氧化钙加热反应生成氨气;氨气的密度比空气小;遇湿润的红色石蕊试纸变蓝;氨气是碱性气体用碱性干燥剂干燥;氨气极易溶于水.
解答:
解:固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;氨气密度比空气轻,易溶于水,用向下排空气法收集;干燥氨气需要选择碱性干燥剂碱石灰;检验氨气是否已经收集满的方法,用一张湿润的红色石蕊试纸接近试管口,试纸变蓝说明已收集满;氨气极易溶于水,实验过程中为防止多余的氨气污染空气,可以选择水进行尾气处理.
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;向下排气集气;碱石灰;用一张湿润的红色石蕊试纸接近试管口,试纸变蓝说明已收集满;用水进行尾气处理.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
点评:本题考查了实验室氨气的制备装置和试剂选择,反应原理的分析判断,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
设NA代表阿伏加德罗常数的值,下列说法中不正确的是( )
| A、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| B、8.4gNaHCO3固体中含HCO3-数目为0.1NA |
| C、1mol氯气与氢氧化钙完全反应生成氯化钙和次氯酸钙,转移的电子数为2NA |
| D、常温下,4.6gNa和足量的O2完全反应失去电子数为0.2NA |
用干燥的烧瓶集满一瓶氯化氢气体做喷泉实验,没有看到喷泉现象,下列哪种操作可能是导致实验失败的主要原因( )
| A、水中没有加石蕊 |
| B、装置的气密性不好 |
| C、烧瓶中收集的氯化氢较多 |
| D、连接烧瓶与烧杯的导管较短 |
 如图为原电池装置示意图,
如图为原电池装置示意图,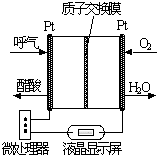 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.