题目内容
9.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、Cl2(写出其中两种物质的化学式).
(4)X2M分子中.M原子的杂化类型为sp3杂化,X2M分子的空间构型为V形.写出X2M在足量氧气中燃烧的化学方程式反应:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
(5)ZX的电子式为
 ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
分析 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),据此解答.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体).
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,
非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,
故答案为:HClO4;H2S;
(3)Y的单质O3、G的单质Cl2、二者形成的ClO2可作消毒剂,故答案为:O3、Cl2等;
(4)H2S分子中S原子有2对孤对电子,形成2个S-H键,杂化轨道数目为4,S原子采取sp3杂化,H2S分子的空间构型为V形,H2S在足量氧气中燃烧的化学方程式反应:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
故答案为:sp3杂化;V形;2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O;
(5)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为  ,Na与水反应是氢氧化钠与氢气,反应化学方程式为:NaH+H2O=NaOH+H2↑,
,Na与水反应是氢氧化钠与氢气,反应化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为: ;NaH+H2O=NaOH+H2↑.
;NaH+H2O=NaOH+H2↑.
点评 本题以元素推断为载体,考查了元素化合物的性质、元素周期律、空间构型与杂化方式判断、电子式等,能正确判断元素是解本题的关键,注意(5)中NaH电子式书写中氢负离子的2个电子成对,不能分开.

| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
| A. | 3:2 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
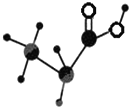 如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )| A. | 结构简式是C3H6O2 | B. | 不能和NaOH溶液反应 | ||
| C. | 官能团是羟基 | D. | 能发生取代反应 |
| A. |  | B. |  | C. |  | D. |  | ||||
| E. |  |

 .
.