题目内容
1.有A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素,且原子序数依次增大.已知A和B具有相同的电子层数,且A的L层电子数是K层电子数的两倍; C单质燃烧时呈现黄色火焰,C单质在高温下与B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物; E元素的最低负价为负一价;F元素位于周期表中第四周期,它的氧化物中有一种常做涂料和红色油漆.试根据以上叙述回答:(1)写出下列元素的名称:A碳,D硫.
(2)写出B元素在周期表中的位置第二周期第VIA族.
(3)用电子式表示化合物 CE 的形成过程
 .
.(4)如何检验FE2溶液中的金属阳离子(答操作、现象及结论)取少量的FeCl2溶液于一试管中,向其中加入几滴硫氰化钾溶液,溶液不变色.再向试管中加入适量的氯水,若溶液变红色,则FeCl2溶液中有Fe2+.
分析 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素,且原子序数依次增大.A的L层电子数是K层电子数的两倍,则L层电子数为4,故A为碳元素; C单质燃烧时呈现黄色火焰,则C为Na;A和B具有相同的电子层数,二者同周期,C单质在高温下与B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为O元素、D为S元素;E元素的最低负价为负一价,原子序数大于硫,则E为Cl;F元素位于周期表中第四周期,它的氧化物中有一种常做涂料和红色油漆,则F为Fe.
解答 解:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素,且原子序数依次增大.A的L层电子数是K层电子数的两倍,则L层电子数为4,故A为碳元素; C单质燃烧时呈现黄色火焰,则C为Na;A和B具有相同的电子层数,二者同周期,C单质在高温下与B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为O元素、D为S元素;E元素的最低负价为负一价,原子序数大于硫,则E为Cl;F元素位于周期表中第四周期,它的氧化物中有一种常做涂料和红色油漆,则F为Fe.
(1)A为碳元素,D为硫元素,故答案为:碳;硫;
(2)B为O元素,在周期表中的位置:第二周期第VIA族,故答案为:第二周期第VIA族;
(3)用电子式表示化合物 NaCl 的形成过程: ,
,
故答案为: ;
;
(4)检验FeCl2溶液中的金属阳离子方法:取少量的FeCl2溶液于一试管中,向其中加入几滴硫氰化钾溶液,溶液不变色.再向试管中加入适量的氯水,若溶液变红色,则FeCl2溶液中有Fe2+,
故答案为:取少量的FeCl2溶液于一试管中,向其中加入几滴硫氰化钾溶液,溶液不变色.再向试管中加入适量的氯水,若溶液变红色,则FeCl2溶液中有Fe2+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,理解掌握用电子式表示化学键或物质的形成.

| A. | HCOOH是还原剂 | B. | ClSO3H被还原 | ||
| C. | 反应后溶液的酸性增强 | D. | ClSO3H是离子化合物 |

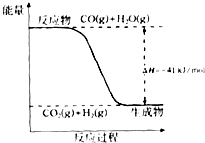 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示: ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
 ,取代反应
,取代反应 ,取代反应
,取代反应 .
.