题目内容
4.同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则两个容器中H2和NH3的体积比是( )| A. | 3:2 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
分析 同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则H2和NH3的物质的量之比为$\frac{1}{2}$:$\frac{1}{3}$=3:2,同温同压下气体的体积之比等于其物质的量之比.
解答 解:同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则H2和NH3的物质的量之比为$\frac{1}{2}$:$\frac{1}{3}$=3:2,同温同压下气体的体积之比等于其物质的量之比,故两个容器中H2和NH3的体积比是3:2,故选:A.
点评 本题考查物质的量有关计算,关键是根据H原子数目相等确定物质的量关系,注意对公式的理解与灵活应用.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
14.中国科学家利用干冰和金属钠在不锈钢反应釜中反应合成出微米级金刚石,其反应为CO2(s)+Na$\stackrel{440℃}{→}$金刚石+石墨+Na2CO3.下列说法不正确的是( )
| A. | 金刚石与石墨互为同素异形体 | |
| B. | 11.5 g金属钠的物质的量为0.5 mol | |
| C. | 44 g CO2在标准状况下的体积为22.4 L | |
| D. | 该反应中碳元素发生了氧化反应 |
15.下列有关热化学方程式及其叙述正确的是( )
| A. | H2的燃烧热为285.8 kJ/mol,则H2O电解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为 $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则C的燃烧热为110.5 kJ/mol | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol |
19.同周期的X、Y、Z三元素,其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
| A. | 原子半径X>Y>Z | |
| B. | 电负性按X、Y、Z的顺序由弱到强 | |
| C. | 非金属性X>Y>Z | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
13.氯磺酸(ClSO3H)是一元强酸,它能与甲酸发生反应:HCOOH+ClSO3H→CO+HCl+H2SO4,关于该反应下列说法正确的是( )
| A. | HCOOH是还原剂 | B. | ClSO3H被还原 | ||
| C. | 反应后溶液的酸性增强 | D. | ClSO3H是离子化合物 |
14.下列化学反应中,离子方程式表示正确的是( )
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe3++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | Na2SO4溶液与BaCl2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
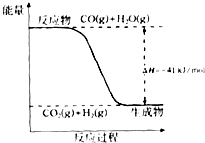 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示: ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.