题目内容
10.下列烷烃的一氯取代物中没有同分异构体的是( )| A. | 2-甲基丙烷 | B. | 丙烷 | C. | 丁烷 | D. | 甲烷 |
分析 烷烃的一氯取代物中没有同分异构体,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,根据等效氢原子的判断方法来回答.
解答 解:A.2-甲基丙烷中有2种H原子,其一氯代物有2种,故A不符合;
B.丙烷分子中有2种H原子,其一氯代物有2种,故B不符合;
C.丁烷有正丁烷、异丁烷,正丁烷分子种有中有2种H原子,其一氯代物有2种,异丁烷中有2种H原子,其一氯代物有2种,故丁烷的一氯代物有4种,故C不符合;
D.甲烷分子中只有1种H原子,其一氯代物只有一种,故D符合;
故选D.
点评 本题考查同分异构体的书写,比较基础,注意利用等效氢进行的判断.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
20.如图是部分周期元素化合价与原子序数的关系图,下列说法正确的是( )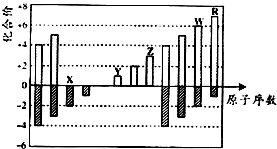

| A. | 原子半径:Z<Y<X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
1.一个原子在第三电子层有10个电子,该原子第三电子层电子排布可以写成( )
| A. | 3s23p8 | B. | 3d10 | C. | 3s23p64s2 | D. | 3s23p63d2 |
18.下列叙述中,可以肯定是一种主族金属元素的是( )
| A. | 原子最外层有3个电子的一种金属 | |
| B. | 熔点低于100℃的一种金属 | |
| C. | 次外电子层上有8个电子的一种元素 | |
| D. | 除最外层,原子的其他电子层电子数目均达饱和的一种金属 |
5.某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验.已知:c(H2SO4)=4.5mol•L-1,反应均需要搅拌60min.
(1)实验①和②的目的是其它条件不变,温度对稀硫酸溶解铝粉量的影响.
为了获得铝粉溶解量,还需要测量的数据是反应60min后剩余铝粉的质量.
(2)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=20℃,V2=15 mL.
(3)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解.原因是少量的Cu与Al构成原电池,使反应速率加快.
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | 20 | 不加 | 20 | 20 | 2.0050 | ﹨ |
| ④ | t2 | 5mL0.01mol•L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
为了获得铝粉溶解量,还需要测量的数据是反应60min后剩余铝粉的质量.
(2)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=20℃,V2=15 mL.
(3)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解.原因是少量的Cu与Al构成原电池,使反应速率加快.
15.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液与稀硝酸反应:Ca(HCO3)2+2H+=Ca2++CO2↑+H2O | |
| C. | 金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | |
| D. | 用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
2.将下列气体通入水中,既能生成含氧酸,又能生成无氧酸的是( )
| A. | 氯气 | B. | 二氧化氮 | C. | 二氧化碳 | D. | 二氧化硫 |
19.pH均为2的HCl和CH3COOH的两种溶液各1L,分别加入足量的Na2CO3粉末,下列说法正确的是( )
| A. | 二者反应的平均速率相等 | B. | 二者溶质的物质的量浓度不相等 | ||
| C. | 二者生成二氧化碳的体积相等 | D. | 二者中氢离子的浓度不相等 |
20.下列离子方程式正确的是( )
| A. | Ca(HCO3)2与少量NaOH溶液的反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 少量SO2通入NaClO溶液中:3ClO-+SO2+H2O═Cl-+SO42-+2HClO | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| D. | NH4HSO4和少量Ba(OH)2溶液反应NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O |