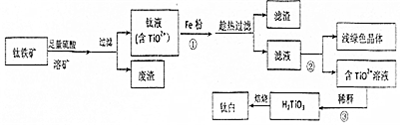
题目内容
9.下列叙述正确的是( )| A. | 金属氧化物不一定是碱性氧化物 | |
| B. | HC1、H2S、NH3都是电解质 | |
| C. | 强酸强碱都是离子化合物 | |
| D. | FeBr3、FeCl2、CuS都不能直接用化合反应制备 |
分析 A、能和酸反应生成盐和水的氧化物为碱性氧化物;
B、在水溶液中或熔融状态下能导电的化合物为电解质;
C、由离子键构成的化合物为离子化合物;
D、FeBr3、FeCl2可以直接由化合反应制备.
解答 解:A、能和酸反应生成盐和水的氧化物为碱性氧化物,而金属氧化物不一定是碱性氧化物,如氧化铝是两性氧化物,过氧化钠是碱性氧化物,故A正确;
B、在水溶液中或熔融状态下能自身电离出自由离子而导电的化合物为电解质,而氨气溶于水后是生成的一水合氨电离出自由离子而导电的,故氨气不是电解质,故B错误;
C、由离子键构成的化合物为离子化合物,而强酸中的化学键全部是共价键,故不是离子化合物,故C错误;
D、FeBr3、FeCl2可以直接由化合反应制备:2Fe+3Br2$\frac{\underline{\;加热\;}}{\;}$2FeBr3,2FeCl3+Fe=3FeCl2,故D错误.
故选A.
点评 本题考查了金属氧化物和碱性氧化物的概念以及电解质非电解质的判断等,难度不大,应注意的是氯化亚铁可以通过化合反应得到,但不能通过单质间的化合得到.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
6.下列各组离子可能大量共存的是( )
| A. | 可使石蕊试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| B. | 能与金属铝反应放出氢气的溶液中:Fe2+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 含有HCO3-的溶液中:K+、A13+、NO3-、Ca2+ |
3.咖啡酸具有较广泛的抑菌作用,结构简式为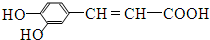 .下列有关说法中正确的是( )
.下列有关说法中正确的是( )
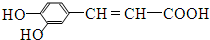 .下列有关说法中正确的是( )
.下列有关说法中正确的是( )| A. | 分子中含有四种官能团 | |
| B. | 可以用酸性高锰酸钾溶液检验碳碳双键 | |
| C. | 1mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1:2 | |
| D. | 1mol咖啡酸可与4mol Br2发生反应 |
14.下列关于胶体的叙述中正确的是( )
| A. | 胶体是一种液态混合物,属于分散系的一种 | |
| B. | 用丁达尔效应可区分Fe(OH)3胶体、水、CuSO4溶液 | |
| C. | 用过滤器可以将胶体和溶液分开 | |
| D. | 胶体的本质特征是发生丁达尔效应 |
1.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
18.下列实验操作中错误的是( )
| A. | 实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
19.在298K,1.01×105Pa下•将22gCO2通入750mllmol/LNaOH溶液中充分反应,测得放出xkJ的热量.己知在该条件下,1molCO2通入1L2mol/LNaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
| A. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2y-x)kJ/mol | |
| B. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2x-y)kJ/mol | |
| C. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(4x-y)kJ/mol | |
| D. | 2CO2 (g)+2NaOH (1)═2NaHCO3 (1)△H=-(8x-2y)kJ/mol |