题目内容
有Al、CuO、Fe2O3组成的混合物共8.0g,放入500mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250mL 3.0mol/L的NaOH溶液时,得到的沉淀最多.上述盐酸溶液的液度为( )
| A、0.5 mol/L |
| B、1.0 mol/L |
| C、1.5 mol/L |
| D、2.0 mol/L |
考点:有关混合物反应的计算
专题:守恒法
分析:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最多,应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据钠离子守恒有n(NaCl)=n(NaOH),根据氯离子守恒有n(HCl)=n(NaCl),再根据c=
计算.
| n |
| V |
解答:
解:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最多,应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据钠离子守恒有n(NaCl)=n(NaOH)=0.25L×3.0mol/L=0.75mol,根据氯离子守恒有n(HCl)=n(NaCl)=0.75mol,故该盐酸的物质的量浓度=
=1.5mol/L,故选C.
| 0.75mol |
| 0.5L |
点评:本题考查混合物的有关计算、物质的量浓度计算,明确整个反应过程,根据离子守恒计算,侧重对学生分析解决问题的能力,难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.下列生产乙醇的反应中,原子利用率最高的是( )
A、乙烯水化:CH2=CH2+H2O
| |||
B、葡萄糖发酵:C6H12O6
| |||
C、溴乙烷水解:CH3CH2Br+H2O
| |||
D、丙酸乙酯水解:CH3CH2COOCH2CH3+H2O
|
有一在空气中暴露过的KOH固体,经分析测知含H2O3.12%,K2CO36%,其余为KOH.取此样品m g溶于100g 98%的硫酸里,残酸需加 n g KOH才刚好中和完全.由此可知蒸发中和后的溶液可得到多少克固体?( )
| A、14.2mg | ||
| B、174g | ||
C、
| ||
| D、无法计算 |
下列说法中正确的是( )
| A、可以利用紫色石蕊试液一次性把NaOH 溶液、稀硫酸、NaCl溶液鉴别出来 |
| B、可以按溶解、过滤、蒸发的操作顺序将硝酸钾和硝酸钠它们分离出来 |
| C、用氢气还原氧化铜实验中,先加热再通入氢气 |
| D、稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
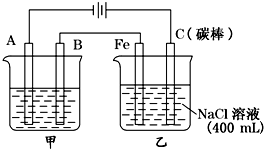 如图为相互串联的甲乙两电解池
如图为相互串联的甲乙两电解池 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验.