题目内容
9.洗涤盛放过植物油的试管,宜选用的试剂是( )| A. | 稀硫酸 | B. | 热的碳酸钠溶液 | C. | 热水 | D. | 浓硝酸 |
分析 植物油在热碱性溶液中可水解生成溶于水的物质,然后利用蒸馏水洗涤即可,以此来解答.
解答 解:植物油在热碱性溶液中可水解生成溶于水的物质,且水解为不可逆,然后利用蒸馏水洗涤即可,而在热水及酸性条件下均可发生水解,但油的水解不彻底,
故选B.
点评 本题考查混合物的分离提纯,为高频考点,把握油脂的性质及发生的反应为解答的关键,侧重元素化合物知识应用的综合考查,题目难度不大.

练习册系列答案
相关题目
19.下列叙述中正确的是( )
| A. | 离子化合物中可能含共价键 | |
| B. | 共价化合物中可能含离子键 | |
| C. | 两种元素构成的共价化合物分子中的化学键都是极性键 | |
| D. | 含有非极性键的化合物一定是共价化合物 |
4.已知:CO2+NaOH(少量)=NaHCO3,CO2+2Na0H(过量)=Na2CO3+H2O,现用含0.2molNaOH的溶液吸收一定量的CO2,将所得熔液低温蒸干得到固体甲(该温度下NaHCO3不分解).下列说法正确的是( )
| A. | 固体甲一定是Na2CO3 | |
| B. | 固体甲一定是NaHCO3 | |
| C. | 当吸收0.15molCO2时,所得固体甲中Na2CO3和NaHCO3物质的量相等 | |
| D. | 在固体甲中加入足量稀盐酸,充分反应后蒸干所得溶液,得到11.7gNaCl |
2.在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
(1)甲组实验中,盐酸过量 (填“过量”“适量”或“不足量”),乙组实验中,盐酸不足量(填“过量”“适量”或“不足量”).参考合适的数据计算出盐酸的物质的量浓度为1mol/L.
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
20.用NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 14 g氮气所含质子数目为7 NA | |
| B. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| C. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.2NA | |
| D. | 1molNa2O2中离子总数是3NA |

 ,F
,F .
.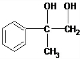 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.