题目内容
某学生设计了如下实验: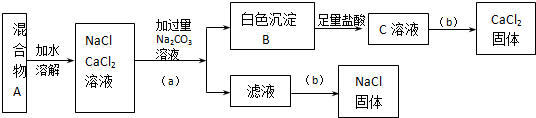
回答下列问题:
(1)如图括号内的操作步骤a为 ,b为 .
(2)写出生成B的离子方程式 ,生成C的离子方程式 .
(3)按此实验方案得到的NaCl固体是否 (填“是”或“否”)纯净?(若纯净,以下不填)若不纯净,则改进的措施是: (简要文字说明).

回答下列问题:
(1)如图括号内的操作步骤a为
(2)写出生成B的离子方程式
(3)按此实验方案得到的NaCl固体是否
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:(1)分离难溶物和溶液采用过滤方法;从滤液中制取固体采用蒸发溶剂的方法;
(2)氯化钙和碳酸钠发生复分解反应生成碳酸钙;碳酸钙和稀盐酸发生复分解反应生成氯化钙;
(3)因为碳酸钠过量,会导致滤液中含有碳酸钠,碳酸钠和HCl反应能生成NaCl.
(2)氯化钙和碳酸钠发生复分解反应生成碳酸钙;碳酸钙和稀盐酸发生复分解反应生成氯化钙;
(3)因为碳酸钠过量,会导致滤液中含有碳酸钠,碳酸钠和HCl反应能生成NaCl.
解答:
解:(1)分离难溶物和溶液采用过滤方法,所以a操作是分离难溶物碳酸钙和滤液,可以采用过滤方法;从滤液中制取溶质,可以采用蒸发溶剂的方法,所以其操作是蒸发结晶,故答案为:过滤;蒸发(结晶);
(2)氯化钙和碳酸钠发生复分解反应生成碳酸钙,离子方程式为Ca2++CO32-=CaCO3↓;碳酸钙和稀盐酸发生复分解反应生成氯化钙、二氧化碳和水,
离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:Ca2++CO32-=CaCO3↓;CaCO3+2H+=Ca2++CO2↑+H2O;
(3)因为碳酸钠过量,会导致滤液中含有碳酸钠,碳酸钠和HCl反应能生成NaCl,所以制得的氯化钠不纯净,可以向滤液中加入适量盐酸再进行蒸发,从而除去碳酸钠,故答案为:否;向滤液中加入适量的盐酸后再进行蒸发结晶.
(2)氯化钙和碳酸钠发生复分解反应生成碳酸钙,离子方程式为Ca2++CO32-=CaCO3↓;碳酸钙和稀盐酸发生复分解反应生成氯化钙、二氧化碳和水,
离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:Ca2++CO32-=CaCO3↓;CaCO3+2H+=Ca2++CO2↑+H2O;
(3)因为碳酸钠过量,会导致滤液中含有碳酸钠,碳酸钠和HCl反应能生成NaCl,所以制得的氯化钠不纯净,可以向滤液中加入适量盐酸再进行蒸发,从而除去碳酸钠,故答案为:否;向滤液中加入适量的盐酸后再进行蒸发结晶.
点评:本题考查物质的分离和提纯,明确物质的性质是解本题关键,侧重考查学生分析能力、实验操作能力,能从整体上把握分析解答,题目难度不大.

练习册系列答案
相关题目
化学与生活、医疗密切相关,在生活中常用的下列物质中,其化学式与俗名和分类都正确的是( )
| 选项 | 物质化学式 | 俗名 | 分类 |
| A | CuSO4?5H2O | 胆矾 | 纯净物 |
| B | NaClO | 漂白粉 | 盐 |
| C | C6H12O6 | 酒精 | 有机化合物 |
| D | Na2CO3 | 纯碱 | 碱 |
| A、A | B、B | C、C | D、D |
下列实验能达到实验目的是( )
| A、比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol?L-1NaOH溶液中 |
| B、除去氯化钠溶液中少量的纯碱:加入过量氯化钙溶液,过滤 |
| C、使用量筒、容量瓶、烧杯、玻璃棒就可准确配制一定物质的量浓度的盐酸 |
| D、将浓硫酸沿烧杯内壁慢慢注入浓硝酸中,并不断搅拌,配制浓硫酸和浓硝酸的混酸 |
下列说法中,正确的是( )
| A、冰融化是化学变化 |
| B、电解饱和食盐水是物理变化 |
| C、碘升华是物理变化 |
| D、原子是最小的微粒,不可再分通电 |
下列有关物质用途的叙述错误的是( )
| A、纯碱是重要的化工原料之一,可用于制化学品、清洗剂、洗涤剂 |
| B、氢氧化铝常用于治疗胃病 |
| C、NO可用于某些疾病的治疗;SO2可用于食品防腐剂 |
| D、明矾具有消毒杀菌作用,可用于净水;硫酸钡可用于钡餐透视 |