题目内容
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图1所示的物质之间的变化:
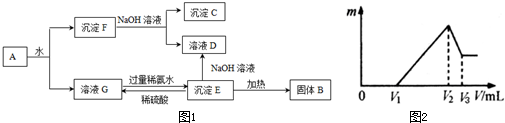
据此回答下列问题:
(1)图1中涉及分离溶液与沉淀的方法是 .
(2)B、C、D 三种物质的化学式为:B ;C ;D .
(3)沉淀E与稀硫酸反应的离子方程式为 .
(4)将沉淀F中存在的两种金属元素组成的合金溶于100mL 4mol/L HCl溶液中,然后再滴加1mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如图2所示.已知V1=160mL.根据以上信息回答:
① (填“能”或“不能”)计算出V3.
②V2为 mL(若能算出具体数字,请在横线上填写具体数字;若不能请在横线上填“不能确定”).

据此回答下列问题:
(1)图1中涉及分离溶液与沉淀的方法是
(2)B、C、D 三种物质的化学式为:B
(3)沉淀E与稀硫酸反应的离子方程式为
(4)将沉淀F中存在的两种金属元素组成的合金溶于100mL 4mol/L HCl溶液中,然后再滴加1mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如图2所示.已知V1=160mL.根据以上信息回答:
①
②V2为
考点:物质分离和提纯的方法和基本操作综合应用,镁、铝的重要化合物
专题:实验设计题,金属概论与碱元素
分析:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠溶液,溶液G中加入过量的氨水得到沉淀E为氢氧化铝,氢氧化铝与氢氧化钠溶液反应得到偏铝酸钠,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵.
(4)①若V1=160mL,说明盐酸有剩余,根据氢氧化钠的量计算剩余盐酸的量,从而得出和金属反应的盐酸的量,但不知道合金中的质量,则计算不出含铝多少,所以不能计算出V3;
②欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,根据盐酸的量计算氢氧化钠的体积.
(4)①若V1=160mL,说明盐酸有剩余,根据氢氧化钠的量计算剩余盐酸的量,从而得出和金属反应的盐酸的量,但不知道合金中的质量,则计算不出含铝多少,所以不能计算出V3;
②欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,根据盐酸的量计算氢氧化钠的体积.
解答:
解:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠,溶液G中加入过量的氨水得到沉淀E为氢氧化铝,氢氧化铝与氢氧化钠溶液反应得到偏铝酸钠,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,
(1)分离溶液和固体的操作是过滤,故答案为:过滤;
(2)通过以上分析知,B是Al2O3,C是Fe2O3,D是NaAlO2,故答案为:Al2O3;Fe2O3;NaAlO2;
(3)沉淀E与稀硫酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)①若V1=160mL,说明盐酸有剩余,根据氢氧化钠的量计算剩余盐酸的量,从而得出和金属反应的盐酸的量,但不知道合金中的质量,则计算不出含铝多少,所以不能计算出V3;故答案为:不能;
②欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,则盐酸的物质的量等于氢氧化钠的物质的量=4mol/L×0.1L=0.4mol,氢氧化钠的体积=
=400mL,
故答案为:400.
(1)分离溶液和固体的操作是过滤,故答案为:过滤;
(2)通过以上分析知,B是Al2O3,C是Fe2O3,D是NaAlO2,故答案为:Al2O3;Fe2O3;NaAlO2;
(3)沉淀E与稀硫酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)①若V1=160mL,说明盐酸有剩余,根据氢氧化钠的量计算剩余盐酸的量,从而得出和金属反应的盐酸的量,但不知道合金中的质量,则计算不出含铝多少,所以不能计算出V3;故答案为:不能;
②欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,则盐酸的物质的量等于氢氧化钠的物质的量=4mol/L×0.1L=0.4mol,氢氧化钠的体积=
| 0.4mol |
| 1mol/L |
故答案为:400.
点评:本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质.

练习册系列答案
相关题目
以下化学用语正确的是( )
| A、H2SO4的电离方程式为:H2SO4=H2++SO4-2 |
| B、铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑ |
C、氯离子的结构示意图: |
| D、乙醇的分子式为C2H6O |
下列化学用语正确的是( )
A、乙酸根离子的结构式: |
| B、3-甲基1-丁烯的结构简式:(CH3)2CHCH═CH2 |
| C、乙酸的结构简式C2H4O2 |
D、醛基的电子式: |
下列实验操作正确的是( )
| A、分液时,上下层液体均从下口放出 |
| B、蒸馏时忘记放碎瓷片可停止加热,冷却后补加 |
| C、蒸发结晶时,应将蒸发皿中的溶液全部蒸干 |
| D、过滤时,为加快过滤速度可搅拌漏斗内的液体 |
下列操作中不正确的是( )
| A、蒸馏烧瓶中温度计的水银球应插入到液体内 |
| B、蒸馏装置中冷凝管进出水的方向是下口进、上口出 |
| C、在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
下列微粒中只有氧化性的是( )
①Cl- ②Fe2+ ③Fe3+ ④S ⑤MnO4- ⑥Ag+ ⑦SO2.
①Cl- ②Fe2+ ③Fe3+ ④S ⑤MnO4- ⑥Ag+ ⑦SO2.
| A、①⑦ | B、②④ |
| C、③⑤⑥ | D、②④⑤⑥ |