题目内容
10.下列各项叙述中正确的是( )| A. | 电子层序数越大,s原子轨道的形状相同,半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 | |
| D. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
分析 A.电子层序数越大,s原子轨道半径越大;
B.在同一能层中电子的自旋方向是可以相同;
C.Mg原子3s2能级上的2个电子吸收能量跃迁到3p2能级上;
D.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子.
解答 解:A.s能级原子轨道都是球形的,且能层序数越大,半径也越大,故A正确;
B.在一个轨道中电子的自旋方向肯定不同,但在同一能层中电子的自旋方向是可以相同,如C原子的核外电子排布 在2P能级上2个电子的自旋方向相同,故B错误;
在2P能级上2个电子的自旋方向相同,故B错误;
C.Mg原子3s2能级上的2个电子吸收能量跃迁到3p2能级上,由基态转化成激发态,故C错误;
D.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,没有杂化的P轨道形成π键,故D错误.
故选A.
点评 本题考查原子核外电子排布,题目难度不大,注意在一个轨道中电子的自旋方向肯定不同,但在同一能层中电子的自旋方向是可以相同.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
20.下列涉及学科观点的有关说法正确的是( )
| A. | 微粒观:二氧化碳是由碳原子和氧原子构成的 | |
| B. | 转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和 | |
| C. | 守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g | |
| D. | 结构观:金刚石和石墨由于结构中碳原子的排列方式不同,性质存在着较大的差异 |
18.下列物质中既含有离子键,又含有极性共价键的是( )
| A. | NaOH | B. | H2O | C. | MgCl2 | D. | Na2O2 |
15.下列物质中含有Cl-的是( )
| A. | 液氯 | B. | KClO3 | C. | HCl气体 | D. | 氯水 |
2.下列各反应中属于水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | HCO3-+H2O?H2CO3+OH- | ||
| C. | HCO3-+OH-=H2O+CO32- | D. | HCO3-+H3O+=2H2O+CO2↑ |
19.下列反应的离子方程式书写正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═Ba SO4↓ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 石灰石溶于稀盐酸:CO32-+2H+=+CO2↑+H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
20.在标准状况下
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3
下列对这四种气体的关系从大到小表达正确的是( )
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3
下列对这四种气体的关系从大到小表达正确的是( )
| A. | 体积 ②>③>④>① | B. | 密度 ②>③>①>④ | ||
| C. | 质量 ②>③>①>④ | D. | 氢原子个数 ②>④>③>① |
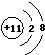 ;D在周期表中位置第三周期第VIA族;E的化学式Na2O2.
;D在周期表中位置第三周期第VIA族;E的化学式Na2O2.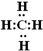 ;
;