题目内容
12.聚合硫酸铁是一种新型高效的无机高分子絮凝剂.用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品.实验室模拟生产过程如下: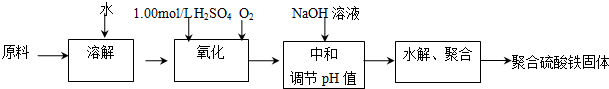
(1)①用原料配制2.50mol/L的FeSO4溶液时用到的定量仪器有:电子天平、容量瓶
②写出氧化过程中的离子方程式:4Fe2++O2+4H+4Fe3++2H2O
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳.加入的硫酸比理论值稍多,但不能过多的原因是硫酸稍过量是为了防止Fe3+水解成氢氧化铁,当硫酸过多时,后续中和需要的碱的用量力大,造成浪费.
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(x Fe2O3•y SO3•z H2O),现采用重量法测定x、y、z的值.
①测定时所需的试剂a c.
(a) NaOH (b) Ba(OH)2(c) BaCl2(d) FeSO4
②需要测定Fe2O3和BaSO4的质量(填写化合物的化学式).
(4)选出测定过程中所需的基本操作aed(按操作先后顺序列出).
(a) 过滤、洗涤(b) 蒸发、结晶(c) 萃取、分液
(d) 冷却、称量(e)烘干或灼烧.
分析 (1)①配制一定物质的是浓度的溶液要称量溶质的质量,用容量瓶定容;
②硫酸亚铁在酸性条件下被氧气氧化成硫酸铁;
(2)硫酸过多,在后面调节pH时要消耗的氢氧化钠的量就多,造成浪费;
(3)①采用重量法测定碱式硫酸铁(x Fe2O3•y SO3•z H2O)中x、y、z的值时,可以将样品溶于氢氧化钠溶液,根据得到的固体氧化铁的质量确定x的值,过滤,在所得滤液中加氯化钡,根据产生的硫酸钡沉淀的质量可确定y的值,根据样品的总质量结合Fe2O3和计算得的SO3的质量可确定z的值;
②根据①的分析可知,要测定Fe2O3、BaSO4的质量;
(4)测定过程中将样品溶于氢氧化钠溶液,经过过滤、洗涤、烘干或灼烧、冷却、称量得氧化铁的质量,在所得滤液中加氯化钡,经过过滤、洗涤、烘干或灼烧、冷却、称量得硫酸钡的质量,据此答题.
解答 解:(1)①配制一定物质的是浓度的溶液要称量溶质的质量,要用电子天平,用容量瓶定容,
故答案为:电子天平、容量瓶;
②硫酸亚铁在酸性条件下被氧气氧化成硫酸铁,反应的离子方程式为4Fe2++O2+4H+4Fe3++2H2O,
故答案为:4Fe2++O2+4H+4Fe3++2H2O;
(2)硫酸稍过量是为了防止Fe3+水解成氢氧化铁,当硫酸过多时,后续中和需要的碱的用量力大,造成浪费,所以加入的硫酸比理论值稍多,但不能过多,
故答案为:硫酸稍过量是为了防止Fe3+水解成氢氧化铁,当硫酸过多时,后续中和需要的碱的用量力大,造成浪费;
(3)①采用重量法测定碱式硫酸铁(x Fe2O3•y SO3•z H2O)中x、y、z的值时,可以将样品溶于氢氧化钠溶液,根据得到的固体氧化铁的质量确定x的值,过滤,在所得滤液中加氯化钡,根据产生的硫酸钡沉淀的质量可确定y的值,根据样品的总质量结合Fe2O3和计算得的SO3的质量可确定z的值,故选a c;
②根据①的分析可知,要测定Fe2O3、BaSO4的质量,
故答案为:Fe2O3、BaSO4;
(4)测定过程中将样品溶于氢氧化钠溶液,经过过滤、洗涤、烘干或灼烧、冷却、称量得氧化铁的质量,在所得滤液中加氯化钡,经过过滤、洗涤、烘干或灼烧、冷却、称量得硫酸钡的质量,故选aed.
点评 本题考查物质的分离和提纯,侧重考查学生获取信息及利用信息能力、分析能力、实验操作能力,注意题给信息的灵活运用,知道常见离子的检验方法及现象,题目难度中等.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| B. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| C. | NO的摩尔质量为30g | |
| D. | 常温常压下32g臭氧中含有的氧原子数目比标准状况下22.4L氧气中含有的氧原子数目少 |
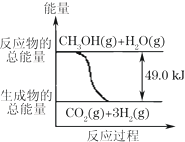 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A. | 1molCH3OH完全燃烧放热192.9kJ | |
| B. | 反应①中的能量变化如右图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,Li0.85NiO2只发生氧化反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向正极移动 |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成;
⑥A与E的溶液中具有相同的阳离子.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4;
(2)A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
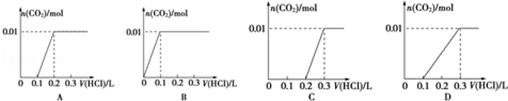
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.
下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C;
(4)向C中滴加过量E溶液,可用一个离子方程式表示Al3++4OH-=AlO2-+H2O;若在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,生成沉淀的物质的量是0.05mol.
| A. | 盐酸与NaOH溶液反应 | B. | 碳酸氢铵受热分解 | ||
| C. | 铝粉与MnO2反应 | D. | 氧化钙溶于水 |