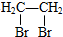题目内容
8. 据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )
据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 该化合物分子式为C21H24O2 | |
| C. | 双酚A能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| D. | 1mol双酚A最多可与4mol浓溴水发生取代反应 |
分析 由结构可知分子式,分子中含酚-OH、碳碳双键,结合酚、烯烃的性质来解答.
解答 解:A.含C、H、O元素,为烃的含氧衍生物,含苯环,为芳香族化合物,故A错误;
B.由图可知,双酚A分子式为C21H24O2,故B正确;
C.含碳碳双键,与溴水发生加成,与高锰酸钾发生氧化反应,均褪色,故C错误;
D.碳碳双键与溴水发生加成反应,酚-OH的邻、对位与溴水发生取代反应,则1mol双酚A最多可与2mol浓溴水发生取代反应,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃的性质及应用,选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
18.大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
请回答下列问题:(1)判断该酸雨中肯定不存在的离子是SO32-、Ba2+
(2)写出试液中滴加淀粉KI溶液时发生反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O
(3)第三份试液滴加NaOH溶液,加热整个过程中有多个反应,写出其中一个反应的离子方程式OH-+H+=H2O,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O.
(4)设计实验方案,检验该溶液中是否存在Cl-:少量试液滴加足量的Ba(NO3)2溶液,静置取上层澄清液加HNO3酸化的AgNO3溶液,若有白色沉淀生成,则证明存在Cl-.
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是催化剂.
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如右图 |  |
(2)写出试液中滴加淀粉KI溶液时发生反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O
(3)第三份试液滴加NaOH溶液,加热整个过程中有多个反应,写出其中一个反应的离子方程式OH-+H+=H2O,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O.
(4)设计实验方案,检验该溶液中是否存在Cl-:少量试液滴加足量的Ba(NO3)2溶液,静置取上层澄清液加HNO3酸化的AgNO3溶液,若有白色沉淀生成,则证明存在Cl-.
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是催化剂.
3.对于下列事实的解释正确的是( )
| A. | 氢氟酸可用于雕刻玻璃,说明氢氟酸具有强酸性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸具有强氧化性 | |
| C. | 常温下浓硫酸可用铝罐贮存,说明铝与浓硫酸不反应 | |
| D. | 氨水可使酚酞试剂变为红色,说明氨水显碱性 |
20.分子式为C4H9Cl的有机物有(不考虑手性结构)( )
| A. | 8种 | B. | 4种 | C. | 3种 | D. | 2种 |
17.甲苯的一氯代物有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
18.乙酸分子结构中,含有的σ键和π键的个数分别是( )
| A. | 7、1 | B. | 6、2 | C. | 3、5 | D. | 4、4 |
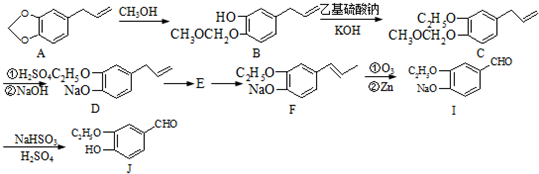
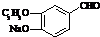 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$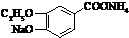 +2Ag↓+3NH3+H2O或
+2Ag↓+3NH3+H2O或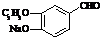 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$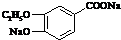 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.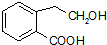 .
. 合成
合成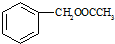 合成路线流程图示例如下:
合成路线流程图示例如下: