题目内容
16.某化工厂生产硫酸,使用一种含杂质25%的黄铁矿样品.已知黄铁矿与氧气反应的化学方程式为4FeS2+11O2═2Fe2O3+8SO2若取1吨该矿石,可制得98%的浓硫酸多少吨?
分析 由反应及原子守恒可知,存在FeS2~2SO2~2H2SO4,以此计算.
解答 解:由反应及原子守恒可知,存在FeS2~2SO2~2H2SO4,
设制得98%的浓硫酸为x,则
FeS2~2SO2~2H2SO4
120 196
1t×75% x×98%
$\frac{120}{196}=\frac{1t×75%}{x×98%}$,
解得x=1.25t,
答:可制得98%的浓硫酸1.251t.
点评 本题考查化学反应的计算,为高频考点,把握关系式法及原子守恒的应用为解答的关键,侧重分析与应用能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
相关题目
6.可以鉴别葡萄糖溶液的试剂是( )
| A. | 银氨溶液 | B. | 氢氧化铜固体 | C. | 石蕊试液 | D. | 碳酸钠溶液 |
4.下列有关化学键的说法正确的是( )
| A. | 离子化合物中一定含有离子键,共价化合物中可能含有离子键 | |
| B. | 共价化合物中一定含有共价键,离子化合物中可能含有共价键 | |
| C. | 由非金属元素形成的化合物中一定只含共价键 | |
| D. | 含有金属元素的化合物中一定含有离子键 |
1.下列各组物质中,化学键全部为共价键的是( )
| A. | NH4Cl、CO2、HCl | B. | O2、KF、SO2 | C. | HCl、CH3COOH、CH4 | D. | Na2O2、N2、H2O |
8. 据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )
据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )
 据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )
据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 该化合物分子式为C21H24O2 | |
| C. | 双酚A能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| D. | 1mol双酚A最多可与4mol浓溴水发生取代反应 |
5.C60是60个碳原子形成的封闭笼状分子,形似足球,它与石墨互为( )
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同一物质 |
6.已知一定温度时:N2(g)+3H2(g)?2NH3(g).当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入0.1mol N2和0.3mol H2,达到平衡时放出热量为Q.则下列关系式中正确的是( )
| A. | Q=9.2 kJ | B. | Q>9.2 kJ | C. | Q<9.2 kJ | D. | Q=18.4kJ |

 ;
;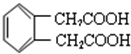 ;
;