题目内容
18.某探究小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质.
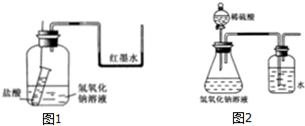
(1)图甲为铁与水蒸气反应的实验装置,实验前应先进行的操作是检查装置气密性.
(2)图甲I为产生水蒸气的装置,图甲II为铁与水蒸气反应的装置,写出硬质玻璃管B内所发生反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)为了验证硬质玻璃管B中反应后的气体产物是H2,还需从图乙中选择必要的仪器和药品,设计出一套装置,其连接顺序为:a连j,f连b,c连h.(填下列装置的接口字母)
(4)反应后,将图甲II装置中硬质玻璃管B内的全部固体置于试管中,加入60mL1mol/L的稀盐酸,固体恰好完全溶解,再滴加KSCN溶液,发现溶液不显血红色,写出此过程中所有可能发生反应的离子方程式Fe3O4+8H+=Fe2++2Fe3++4H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+.反应前硬质玻璃管B中加入Fe粉的质量为1.68g.
分析 (1)图甲为铁与水蒸气反应的实验装置,生成的水蒸气和铁在高温下反应需要装置气密性完好;
(2)硬质玻璃管B内所发生反应是铁和水蒸气反应生成四氧化三铁和氢气;
(3)为了验证硬质玻璃管B中反应后的气体产物是H2,同时含有水蒸气,需要通过装置中的浓硫酸干燥氢气,然后通过装置中的氧化铜发生氧化还原反应生成红色铜和水蒸气,通过无水硫酸铜检验生成的水蒸气存在,最后需要剩余氢气的处理;
(4)反应后,将图甲II装置中硬质玻璃管B内的全部固体置于试管中,加入60mL1mol/L的稀盐酸,固体恰好完全溶解,再滴加KSCN溶液,发现溶液不显血红色,说明无铁离子存在,四氧化三铁溶解后生成亚铁离子和铁离子,说明过量的铁和过量的盐酸反应生成氯化亚铁和氢气,铁离子反应生成亚铁离子,反应后全部生成氯化亚铁,结合元素守恒计算铁粉质量;
解答 解:(1)铁与水蒸气反应的实验装置分析可知,装置中A需要生成水蒸气,通入B中和铁在高温下反应所以需要装置气密性完好,实验前应先进行的操作是检查装置气密性,
故答案为:检查装置气密性;
(2)图甲I为产生水蒸气的装置,图甲II为铁与水蒸气反应的装置,硬质玻璃管B内所发生反应是铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)硬质玻璃管B中反应后的气体产物是H2,同时含有水蒸气,需要通过装置中的浓硫酸干燥氢气,然后通过装置中的氧化铜发生氧化还原反应生成红色铜和水蒸气,通过无水硫酸铜检验生成的水蒸气存在,最后需要剩余氢气的处理,为了验证硬质玻璃管B中反应后的气体产物是H2,其连接顺序为ajfbch,
故答案为:jfbch;
(4)反应后,将图甲II装置中硬质玻璃管B内的全部固体置于试管中,加入60mL1mol/L的稀盐酸,固体恰好完全溶解,再滴加KSCN溶液,发现溶液不显血红色,说明无铁离子存在,四氧化三铁溶解后生成亚铁离子和铁离子,反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O,过量的铁和过量的盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,铁离子反应生成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+,依据元素元素守恒计算,铁元素来源于铁单质,氯元素来源于盐酸溶液中的氯化氢,
FeCl2~2HCl~Fe,
2 1
0.060L×1mol/L n=0.03mol
反应前硬质玻璃管B中加入Fe粉的质量=56g/mol×0.03mol=1.68g,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;1.68.
点评 本题考查了物质制备、物质性质、反应产物的实验验证等知识点,掌握基础是解题关键,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用第试剂KSCN溶液、K3[Fe(CN)6]溶液、氯水.
(1)请完成表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 变成血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6],振荡 | 产生蓝色沉淀 | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性性
用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
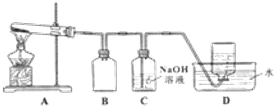
(2)装置B的作用是防倒吸.
(3)经小组讨论并验证该无色气体为O2,其验证方法是用带火星木条靠近瓶口,木条复燃,证明是氧气.
(4)【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硫酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的产物有Ag、O2、NO2.
| A. | 14g N2和32g O2 | B. | 34g NH3 和4g H2 | ||
| C. | 2LCO2和2LH2O | D. | 11.2LO2和0.5molO2 |
| A. | 铜 | B. | 氧化铜 | C. | 氢氧化铜 | D. | 硫酸铜 |
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne互为同素异形体 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne的中子数相同 |

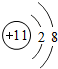 ;
;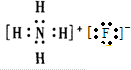 .
.