题目内容
16.某实验小组同学进行如下实验,以检验化学反应中的能量变化.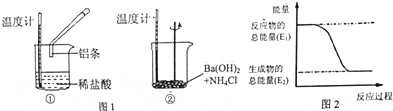
请回答下列问题:
(1)反应①是放热反应,其离子方程式是2Al+6H+═2Al3++3H2↑.
Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,其化学方程式是Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑.反应过程①(填“①”或“②”) 的能量变化可用图2 表示.
(2)现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
①以上两个反应能设计成原电池的是B
②写出设计原电池正、负极电极反应式正极:2Fe3++2e-=2Fe2+;负极:Cu-2e-=Cu2+.
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)①自发进行的放热的氧化还原反应能设计成原电池;
②该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应.
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,离子反应方程式为:2Al+6H+═2Al3++3H2↑;Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应,化学反应方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑;反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;故答案为:放;2Al+6H+═2Al3++3H2↑;吸;Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑;①;
(2)①自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,故答案为:B;
②该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;故答案为:正极:2Fe3++2e-=2Fe2+;负极:Cu-2e-=Cu2+.
点评 本题考查学生根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
| A. | 平衡时SO3的物质的量:a>1.2、b>1.2 | |
| B. | 容器Ⅱ、Ⅲ中平衡常数相同 | |
| C. | 容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 | |
| D. | 若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),则此时ν正<ν逆 |
| A. | 苯的一氯代物只有一种 | B. | 苯的邻位二氯代物只有一种 | ||
| C. | 苯的间位二氯代物只有一种 | D. | 苯的对位二氯代物只有一种 |
| A. | 氰化钾(KCN) | B. | 乙炔(C2H2) | C. | 氰酸铵(NH4CNO) | D. | 碳化硅(SiC) |
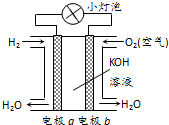
| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
| A. | Na2O2 | B. | KCl | C. | H2S | D. | N2 |
| A. | NH3和H2S | B. | PCl5和HCl | C. | CH4和H2O | D. | HCN和BF3 |
 .
.
 . H2O2
. H2O2 NH4Cl
NH4Cl
 .
.