题目内容
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时价电子的电子排布不可能是( )
| A、X:3d64s2 Y:2s22p4 |
| B、X:2s22p3Y:2s22p4 |
| C、X:3s23p1Y:3s23p4 |
| D、X:3s2Y:3s23p5 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:X、Y两元素可形成X2Y3型化合物,可判断X的可能化合价为+3价,Y的可能化合价为-2价,由此判断最外层电子.
解答:
解:A、当X的电子排布为3d64s2时,为Fe元素,Y:2s22p4为O元素,能形成Fe2O3,故A正确;
B、当X的电子排布为2s22p3时,为N元素,Y:2s22p4为O元素,能形成N2O3,故B正确;
C、当X的电子排布为3s23p1时,为Al元素,Y:3s23p4,为S,能形成Al2S3,故C正确;
D、当X的电子排布为3s2时,为Mg元素,Y:3s23p5,为Cl,能形成MgCl2,故D错误;
故选D.
B、当X的电子排布为2s22p3时,为N元素,Y:2s22p4为O元素,能形成N2O3,故B正确;
C、当X的电子排布为3s23p1时,为Al元素,Y:3s23p4,为S,能形成Al2S3,故C正确;
D、当X的电子排布为3s2时,为Mg元素,Y:3s23p5,为Cl,能形成MgCl2,故D错误;
故选D.
点评:本题考查原子核外电子排布,题目难度不大,注意根据化合物的类型判断可能的化合价,由此推断可能的核外电子排布.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式正确的是( )
| A、向盐酸中滴加氨水:H++OH-=H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ |
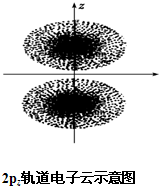 如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )| A、2pz轨道上的电子在空间出现的概率分布是z轴对称 |
| B、点密集的地方表明电子出现的机会多 |
| C、电子先沿z轴正半轴运动,然后在负半轴运动 |
| D、2pz轨道形状为两个椭圆球 |
下列叙述不正确的是( )
| A、1个甘氨酸分子中存在10对共用电子 |
| B、PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C、维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
已知T℃时,水的离子积常数为Kw.该温度下,将等浓度的一元酸HA与一元碱BOH等体积混合,下列描述正确的是( )
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |

