题目内容
( I )有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、Na2SO4、MgCl2中的某几种,现进行如下实验.请根据实验现象回答各问题.
( II)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:

(1)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是 ;不能检出的物质 .
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能检出的物质是 .
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是 ;不能检出的物质 .
| 实验操作 | 实验结论 |
| (1)将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| (2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| (3)在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |

(1)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:(I)(1)将混合物溶于水,得到无色透明溶液,碳酸钙难溶于水,硫酸铜溶解溶液呈蓝色,说明原混合物一定不含CaCO3、CuSO4;
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,可能是生成的碳酸钡、硫酸钡沉淀,再加入稀硝酸,沉淀不溶解,说明沉淀一定不是碳酸钡,是硫酸钡,证明原混合物含有硫酸钠,一定不含碳酸钠;
(3)在另一份溶液中加入NaOH溶液,也产生白色沉淀,证明生成的沉淀是氢氧化镁沉淀,说明原混合物含有MgCl2;
(Ⅱ)木炭粉与浓硫酸反应生成SO2和CO2,方程式为:C+2H2SO4(浓)
2S02↑+C02↑+2H2O,SO2能使品红溶液褪色,SO2也能使酸性高锰酸钾溶液褪色,通过酸性高锰酸钾溶液除去SO2,CO2不能使品红溶液褪色,CO2也不能酸性高锰酸钾溶液褪色.无水硫酸铜遇水变蓝,二氧化硫、二氧化碳都能使澄清石灰水变浑浊,据此即可解答.
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,可能是生成的碳酸钡、硫酸钡沉淀,再加入稀硝酸,沉淀不溶解,说明沉淀一定不是碳酸钡,是硫酸钡,证明原混合物含有硫酸钠,一定不含碳酸钠;
(3)在另一份溶液中加入NaOH溶液,也产生白色沉淀,证明生成的沉淀是氢氧化镁沉淀,说明原混合物含有MgCl2;
(Ⅱ)木炭粉与浓硫酸反应生成SO2和CO2,方程式为:C+2H2SO4(浓)
| ||
解答:
解:(I)(1)将混合物溶于水,得到无色透明溶液,碳酸钙难溶于水,硫酸铜溶解溶液呈蓝色,说明原混合物一定不含CaCO3、CuSO4;
故答案为:CaCO3、CuSO4;
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,可能是生成的碳酸钡、硫酸钡沉淀,再加入稀硝酸,沉淀不溶解,说明沉淀一定不是碳酸钡,是硫酸钡,证明原混合物含有硫酸钠,一定不含碳酸钠;
故答案为:Na2SO4;Na2CO3;
(3)在另一份溶液中加入NaOH溶液,也产生白色沉淀,原混合物中的氯化镁和氢氧化钠反应生成氢氧化镁沉淀,说明原混合物含有MgCl2;
故答案为:MgCl2;
(Ⅱ)(1)①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,②中SO2能使品红溶液褪色,SO2也能使酸性高锰酸钾溶液褪色,③二氧化硫、二氧化碳都能使澄清石灰水变浑浊.如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,通过②中品红溶液褪色,说明有SO2,通过酸性高锰酸钾溶液除去SO2,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不能说明是生成的水,可能是溶液中的水,通过③澄清石灰水,石灰水变浑浊,说明有二氧化碳生成,故答案为:S02和C02;H2O;
(2)如果将仪器的连接顺序变为①、③、②,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,能说明生成有水,通过③澄清石灰水,石灰水变浑浊,二氧化硫、二氧化碳都能使澄清石灰水变浑浊,不可以检出二氧化硫、二氧化碳,故答案为:H2O;S02和C02;
(3)如果将仪器的连接顺序变为②、③、①,通过②中品红溶液褪色,说明有SO2,通过酸性高锰酸钾溶液除去SO2,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过③澄清石灰水,石灰水变浑浊,说明有二氧化碳生成,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不能说明是生成的水,可能是溶液中的水,故答案为:S02和C02;H2O.
故答案为:CaCO3、CuSO4;
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,可能是生成的碳酸钡、硫酸钡沉淀,再加入稀硝酸,沉淀不溶解,说明沉淀一定不是碳酸钡,是硫酸钡,证明原混合物含有硫酸钠,一定不含碳酸钠;
故答案为:Na2SO4;Na2CO3;
(3)在另一份溶液中加入NaOH溶液,也产生白色沉淀,原混合物中的氯化镁和氢氧化钠反应生成氢氧化镁沉淀,说明原混合物含有MgCl2;
故答案为:MgCl2;
(Ⅱ)(1)①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,②中SO2能使品红溶液褪色,SO2也能使酸性高锰酸钾溶液褪色,③二氧化硫、二氧化碳都能使澄清石灰水变浑浊.如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,通过②中品红溶液褪色,说明有SO2,通过酸性高锰酸钾溶液除去SO2,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不能说明是生成的水,可能是溶液中的水,通过③澄清石灰水,石灰水变浑浊,说明有二氧化碳生成,故答案为:S02和C02;H2O;
(2)如果将仪器的连接顺序变为①、③、②,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,能说明生成有水,通过③澄清石灰水,石灰水变浑浊,二氧化硫、二氧化碳都能使澄清石灰水变浑浊,不可以检出二氧化硫、二氧化碳,故答案为:H2O;S02和C02;
(3)如果将仪器的连接顺序变为②、③、①,通过②中品红溶液褪色,说明有SO2,通过酸性高锰酸钾溶液除去SO2,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过③澄清石灰水,石灰水变浑浊,说明有二氧化碳生成,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不能说明是生成的水,可能是溶液中的水,故答案为:S02和C02;H2O.
点评:本题考查了物质检验的实验方法和反应现象的分析判断,、铜与浓硫酸反应产物的检验,注意物质性质和反应现象以及二氧化硫、二氧化碳的化学性质是解答本题的关键,难度中等.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、化学家可以制造出自然界中不存在的物质 |
| B、化学研究的主要目的就是认识分子 |
| C、化学科学与其他科学分支的联系不密切 |
| D、化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 |
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时价电子的电子排布不可能是( )
| A、X:3d64s2 Y:2s22p4 |
| B、X:2s22p3Y:2s22p4 |
| C、X:3s23p1Y:3s23p4 |
| D、X:3s2Y:3s23p5 |
下列有关化学用语错误的是( )
A、Na+的基态电子排布图是: |
B、H2O分子的电子式为: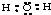 |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: |
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4 第一电离能最大的是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能(kJ?mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ |
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
 )是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应:
)是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应:
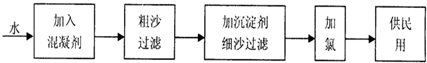
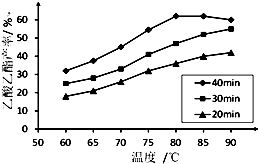 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: