题目内容
14.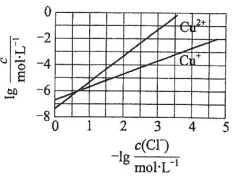 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )| A. | Ksp(CuCl)的数量级为10-7 | |
| B. | 除Cl-反应为Cu+Cu2++2Cl-=2CuCl | |
| C. | 加入Cu越多,Cu+浓度越高,除Cl-效果越好 | |
| D. | 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
分析 A.根据Ksp(CuCl)=c(Cu+)×c(Cl-)判断;
B.涉及反应物为铜、硫酸铜以及氯离子,生成物为CuCl;
C.铜为固体,加入铜的量的多少不能影响化学反应速率和效率;
D.酸性条件下,Cu+不稳定,易发生2Cu+=Cu2++Cu.
解答 解:A.由图象可知,横坐标为1时,lgc(Cu+)大于6,则Ksp(CuCl)的数量级为10-7,故A正确;
B.涉及反应物为铜、硫酸铜以及氯离子,生成物为CuCl,反应的方程式为Cu+Cu2++2Cl-=2CuCl,故B正确;
C.发生Cu+Cu2++2Cl-=2CuCl,反应的效果取决于Cu2+的浓度,如Cu2+不足,则加入再多的Cu也不能改变效果,故C错误;
D.酸性条件下,Cu+不稳定,易发生2Cu+=Cu2++Cu,可知没有Cl-存在的情况下,2Cu+=Cu2++Cu趋向于完全,说明2Cu+=Cu2++Cu的平衡常数很大,故D正确.
故选C.
点评 本题综合考查含铜化合物的性质与应用,侧重考查学生的分析能力和计算能力,注意题给信息以及图标的分析,把握溶度积的计算,难度不大

练习册系列答案
相关题目
5.合成药物异搏定路线中某一步骤如图所示,下列说法错误的是( )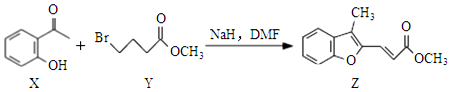
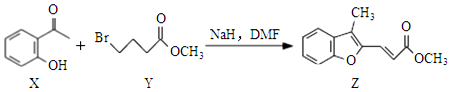
| A. | 物质X的分子中存在2种含氧官能团 | |
| B. | 物质Y可以发生水解和消去反应 | |
| C. | 1molZ最多可与2molBr2发生加成反应 | |
| D. | 等物质的量的X、Y分别与NaOH溶液反应,最多消耗的NaOH的物质的量之比为1:1 |
2.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )
| A. |  瓷器 | B. |  丝绸 | C. |  茶叶 茶叶 | D. |  中草药 中草药 |
17.用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液.
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
f.数据处理.
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
9.温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)?2NO(g)+O2 (g) (正反应吸热).实验测得:v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)•c(O2 ),k正、k逆为速率常数,受温度影响.下列说法正确的是( )
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
 某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
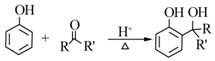
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.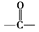 和
和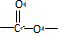 .
.
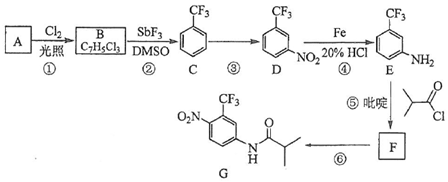
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.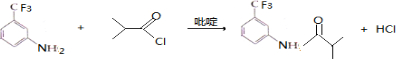 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率. )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(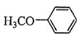 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选).
 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.