题目内容
14.常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到两条滴定曲线,如图所示.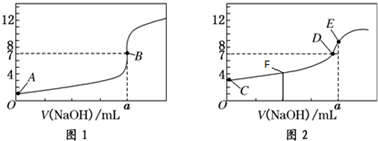
(1)滴定醋酸的曲线是2(填“1”或“2”),判断的理由是醋酸为弱酸,部分电离,与盐酸等浓度时醋酸的pH值大.
(2)a=20mL.
(3)点E所示溶液pH>7,用离子方程式表示其原因CH3COO-+H2O?CH3COOH+OH-.
(4)D点所示溶液中离子浓度由大到小的顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
(5)下列说法正确的是ABCD
A.图1滴定过程中宜选用酚酞作指示剂
B.点F所示溶液中:c(CH3COO-)>c(CH3COOH)
C.点F、D、E所示溶液中:水的电离程度最大的是点D
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
分析 (1)醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,图1为滴定盐酸曲线,图2为滴定醋酸曲线;
(2)a点时氢氧化钠与HCl恰好完全反应;
(3)氢氧化钠与盐酸的浓度相等,则a=20,故E点为CH3COONa溶液,醋酸根离子水解溶液呈碱性;
(4)D点溶液呈中性,则c(H+)=c(OH-),结合电荷守恒判断;
(5)A.滴定终点尽可能落在指示剂变色范围之间;
B.点F时呈酸性,为CH3COONa、CH3COOH混合溶液,醋酸的电离程度大于醋酸根的水解程度;
C.F点为CH3COONa、CH3COOH混合溶液,D点为CH3COONa混合溶液,E点为CH3COONa、NaOH混合溶液;
D.加入的NaOH比较少,形成CH3COONa、CH3COOH混合溶液时可能存在.
解答 解:(1)醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,图1为滴定盐酸曲线,图2为滴定醋酸曲线,
故答案为:2;醋酸为弱酸,部分电离,与盐酸等浓度时醋酸的pH值大;
(2)图1中a点pH=7,氢氧化钠与HCl恰好完全反应,二者浓度相等且按物质的量1:1反应,故a=20mL,
故答案为:20;
(3)氢氧化钠与盐酸的浓度相等,则a=20,故E点为CH3COONa溶液,醋酸根离子水解:CH3COO-+H2O?CH3COOH+OH-,破坏水的电离平衡,溶液呈碱性,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)D点溶液呈中性,则c(H+)=c(OH-),由电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),可得:c(Na+)=c(CH3COO-),钠离子浓度远远大于溶液中氢离子浓度,故离子浓度c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(5)A.滴定终点尽可能落在指示剂变色范围之间,利用酚酞作指示剂误差较小,故A正确;
B.点F时呈酸性,为CH3COONa、CH3COOH混合溶液,醋酸的电离程度大于醋酸根的水解程度,则溶液中c(CH3COO-)>c(CH3COOH),故B正确;
C.F点为CH3COONa、CH3COOH混合溶液,溶液呈酸性,抑制水的电离,D点为CH3COONa混合溶液,促进水的电离,E点为CH3COONa、NaOH混合溶液,抑制水的电离,故D点溶液中水的电离程度最大,故C正确;
D.加入的NaOH比较少,形成CH3COONa、CH3COOH混合溶液时可能存在,故D正确.
故选:ABCD.
点评 本题以滴定曲线为载体,考查弱电解质电离、盐类水解、离子浓度大小比较等,关键根据起始溶液pH判断滴定曲线,较好的考查学生获取信息能力、知识迁移运用能力,是对学生综合能力的考查.

 阅读快车系列答案
阅读快车系列答案| A. | 1mol/L 氢氰酸溶液的pH约为3 | |
| B. | 1mol/L 氢氰酸钠溶液的pH约为8.5 | |
| C. | 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比氢氟酸溶液的弱 |
| A. | 原条件下KCl的溶解度小于ω1g | B. | m1?ω1%-m=m2?ω2% | ||
| C. | ω1一定大于ω2 | D. | m1-m2≤m |
| A. | 1×10-2mol/L | B. | 1×10-7mol/L | C. | 1×10-12mol/L | D. | 1×10-14mol/L |
| 实 验 方 案 | 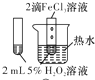 | 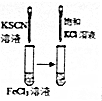 | 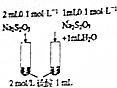 |  |
| 目 的 | A.验证升高温度可加快H2O2分解 | B.探究增大c(Cl-使平衡逆向移动 | C.探究浓度对化学反应速率的影响 | D.验证铁发生析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SO2是污染大气的有害气体之一 | |
| B. | SO2在大气中与水反应生成硫酸,产生酸雨 | |
| C. | SO2可使澄清石灰水变浑浊 | |
| D. | SO2能使品红溶液褪色,加热溶液颜色恢复 |
| A. | 氧化性:Na+>H+>Cu2+ | |
| B. | 还原性:Cl->S2->O2- | |
| C. | 等质量时的耗氧量:C2H6>CH4>C6H6 | |
| D. | 与金属钠反应的剧烈程度:C2H5OH<H2O |
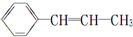 ,下列关于该烃的说法错误的是( )
,下列关于该烃的说法错误的是( )| A. | 该烃易溶于有机溶剂,但不易溶于水 | |
| B. | 1 mol该烃含有1 mol碳碳双键 | |
| C. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 能发生聚合反应,其产物可表示为: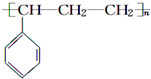 |
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)已知O3与KI溶液反应的生成物中有两种单质是I2和O2.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
②在30°C、pH=4.0条件下,O3的分解速率为1.00×10-4 mol/(L•min).
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为bac.(填字母代号)
a.40°C、pH=3.0 b.10°C、pH=4.0 c.30°C、pH=7.0
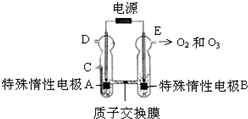
(3)O3可由臭氧发生器(原理如下图)电解稀硫酸制得.
①图中阴极为A(填“A”或“B”),其电极反应式为2H++2e-=H2↑.
②若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O.