题目内容
2.常温下pH=12的NaOH溶液中,由水电离出的c(OH-)是( )| A. | 1×10-2mol/L | B. | 1×10-7mol/L | C. | 1×10-12mol/L | D. | 1×10-14mol/L |
分析 氢氧化钠溶液中,氢氧根离子抑制了水的电离,其溶液中的氢离子是水的电离的,pH=12的氢氧化钠溶液中的氢离子浓度为1×10-12mol/L.
解答 解:常温下pH=12的NaOH溶液中,氢氧根离子抑制了水的电离,则氢氧化钠溶液中的氢离子是水的电离的,水电离的氢氧根离子与氢离子浓度相等,所以由水电离出的c(OH-)=1×10-12mol/L,
故选C.
点评 本题考查了溶液pH的计算、水的电离及其影响,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意酸碱溶液、能够水解的盐溶液对水的电离的影响情况,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目
13.下有物质归类正确的是( )
| A. | 胶体:豆浆、墨水、血液、生理盐水 | |
| B. | 单质:冰、液氯、臭氧、红磷 | |
| C. | 混合物:矿泉水、84消毒液、铝热剂、四氧化三铁 | |
| D. | 常见的氧化剂:高锰酸钾、氯气、硝酸、氧气 |
17.能够测定分子中的化学键并推测其结构和官能团的方法是( )
①.质谱 ②.红外光谱 ③.紫外光谱 ④.核磁共振谱.
①.质谱 ②.红外光谱 ③.紫外光谱 ④.核磁共振谱.
| A. | ①③ | B. | ② | C. | ③④ | D. | ①④ |
7.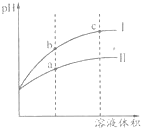 某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
 某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | Ⅱ为盐酸稀释时pH变化曲线 | |
| B. | b点溶液的导电性比c点溶液的导电性强 | |
| C. | a点Kw数值比c点Kw数值大 | |
| D. | pH=2的盐酸和醋酸,盐酸的物质的量浓度大 |
11.下列离子方程式中,正确的是( )
| A. | KOH溶液和 KHSO4反应H++OH-=H2O | |
| B. | 铜和三氯化铁溶液反应Cu+Fe3+═Fe2++Cu2+ | |
| C. | 金属铝投入NaOH溶液中2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| D. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O |
 (1)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式分别为Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
(1)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式分别为Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-