题目内容
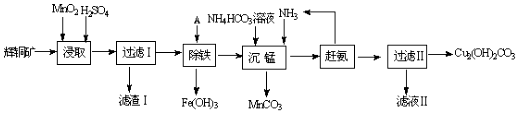
11.下列有关实验的选项正确的是( )| A装置实验说明 Ksp(AgCl)>Ksp(Ag2S) | B.制备Fe(OH)2沉淀 | C.苯萃取碘水中的I2,分出水层后的操作 | D.记录滴定终点读数 为12.20mL |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.试管中硝酸银足量,发生沉淀的生成;
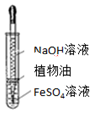
B.植物油隔绝空气,防止氢氧化亚铁被氧化;
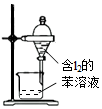
C.苯的密度比水的密度小,萃取后在上层;
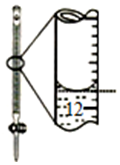
D.小刻度在上方,液面的凹液面在刻度线12的上方.
解答 解:A.试管中硝酸银足量,发生沉淀的生成,不发生沉淀的转化,不能比较Ksp,故A错误;
B.植物油隔绝空气,防止氢氧化亚铁被氧化,图中装置可制备,故B正确;
C.苯的密度比水的密度小,萃取后在上层,则分液漏斗下层为水层,故C错误;
D.图中记录滴定终点读数为11.80mL,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握沉淀的生成、物质的制备、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.《中国能源矿产地质调查报告》显示我国天然气水合物超千亿吨油当量.天然气主要成分为( )
| A. | H2 | B. | CO | C. | CH4 | D. | C2H4 |
19.用蘸有浓氨水的棉棒检漏输氯管道的原理为:3Cl2+8NH3═N2+6NH4Cl.该反应的下列说法正确的是( )
| A. | 35.5g氯气所含的分子数为6.02×1023 | |
| B. | 常温常压下,22.4L氨气所含原子总数为4×6.02×1023 | |
| C. | 反应每生成1molN2转移电子数约为6×6.02×1023 | |
| D. | 1mol•L-1NH4Cl溶液中,含有Cl-数约为6.02×1023 |
6.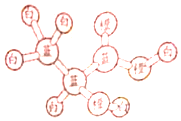 某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )
某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )
 某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )
某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )| A. | 1mol该有机物可与2molNa反应,生成1mol气体 | |
| B. | 该有机物可以发生加聚反应 | |
| C. | 该有机物可以发生取代反应,氧化反应、酯化反应 | |
| D. | 该有机物可以生成分子式为C6H8O4的酯 |
3.下列根据实验操作和现象所得出的结论错误的是( )
| A. | 用酒精灯外焰加热铝箔,铝箔熔化但不滴落,说明Al2O3>Al | |
| B. | 锅炉水垢CaSO4可用Na2CO3溶液浸泡,再用酸溶解去除,说明Ksp:CaCO3>CaSO4 | |
| C. | 向Na2SiO3溶液中通入适量CO2气体,有白色沉淀生成,说明酸性:H2CO3>H2SiO3 | |
| D. | 当光束通过淀粉溶液时,出现一条光亮的“通路”,说明分散质微粒的直径在1-100nm之间 |
7.下列说法正确的是( )
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 福尔马林、水玻璃、氨水均为混合物 | |
| D. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |