题目内容
7.用18mol•L-1浓硫酸配制100mL 1.0mol•L-1 稀硫酸,回答下列问题:(1)所需浓硫酸的体积是5.6mL (保留一位小数,2分);
(2)下列情况对所配制的稀硫酸浓度有何影响?(填写“偏大”、“偏小”或“无影响”)
①稀释浓硫酸后立刻转移到容量瓶中定容:偏大;
②容量瓶用蒸馏水洗涤后没干燥就开始移液:无影响;
③量取浓硫酸时俯视量筒刻度线:偏小;
④定容时俯视容量瓶刻度线:偏大.
分析 (1)根据溶液稀释前后溶质物质的量不变,计算所需浓硫酸的体积;
(2)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,
所以xmL×18mol/L=100mL×1.0mol/L,解得:x≈5.6,
故答案为:5.6;
(2)①未等稀释后的硫酸冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏大,
故答案为:偏大;
②容量瓶中原有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,所以不影响配制结果,
故答案为:无影响;
③俯视量筒刻度线,浓硫酸的体积偏小,所配溶液浓度偏小,
故答案为:偏小;
④定容时俯视容量瓶刻度线,导致所配溶液体积减小,所配溶液浓度偏大,
故答案为:偏大.
点评 本题考查了一定物质的量浓度溶液的配制,注意从c=$\frac{n}{V}$解配制原理,注意浓硫酸的稀释操作,题目难度不大.

练习册系列答案
相关题目
16.下列叙述正确的是( )
| A. | 配制100mL 1.0mol/LCuSO4溶液:将25g CuSO4•5H2O溶于100mL蒸馏水中 | |
| B. | 配制6mol/L100mL硫酸时,定容后应将容量瓶沿顺时针方向摇匀 | |
| C. | 盛放NaOH溶液时,使用带玻璃塞的磨口瓶 | |
| D. | 可以采用溶解、蒸发浓缩、冷却结晶、过滤的方法分离NaCl和KNO3固体混合物 |
13.对于氨水的电离,下列哪个量只随温度变化而变化( )
| A. | 溶液的pH值 | B. | 电离度 | ||
| C. | 电离平衡常数 | D. | 平衡后,氨水的电离速率 |

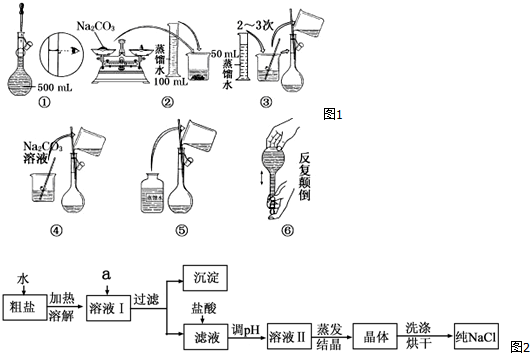

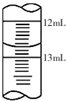 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):