题目内容
向部分被氧化的Zn粉7.31g中逐滴加入1mol/L盐酸(密度1.015g/cm3),当加到220mL时,锌粉恰好与盐酸完全反应.求所得氯化锌溶液的物质的量浓度(设反应后溶液体积仍为220mL ),及溶质的质量分数.(书写计算过程)
考点:物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:物质的量浓度和溶解度专题
分析:发生反应:Zn+2HCl=ZnCl2+H2↑、ZnO+2HCl=ZnCl2+H2O,设Zn和ZnO的物质的量分别为x、y,根据方程式表示氯化锌、氢气的物质的量,根据质量及HCl的物质的量列方程计算,进而计算氯化锌的物质的量浓度,溶液质量=7.31g+盐酸质量-氢气质量,再根据质量分数定义计算.
解答:
解:设Zn和ZnO的物质的量分别为x、y,则:
Zn+2HCl=ZnCl2+H2↑ ZnO+2HCl=ZnCl2+H2O
x 2x x x y 2y y
所以:65 g/mol×x+81 g/mol×y=7.31 g
2x+2y=1 mol/L×0.22 L=0.220 mol
解得x=0.1mol y=0.01mol
故n(ZnCl2)=0.1mol+0.01mol=0.11 mol,c(ZnCl2)=
=0.5 mol/L
ω(ZnCl2)=
=6.49%,
答:所得氯化锌溶液的物质的量浓度为0.5mol/L,溶质的质量分数为6.49%.
Zn+2HCl=ZnCl2+H2↑ ZnO+2HCl=ZnCl2+H2O
x 2x x x y 2y y
所以:65 g/mol×x+81 g/mol×y=7.31 g
2x+2y=1 mol/L×0.22 L=0.220 mol
解得x=0.1mol y=0.01mol
故n(ZnCl2)=0.1mol+0.01mol=0.11 mol,c(ZnCl2)=
| 0.11mol |
| 0.22L |
ω(ZnCl2)=
| 0.11mol×136g/mol |
| 220mL×1.015g/mL+7.31g-0.1mol×2g/mol |
答:所得氯化锌溶液的物质的量浓度为0.5mol/L,溶质的质量分数为6.49%.
点评:本题考查混合物计算、化学方程式计算,比较基础,注意溶液质量计算,学生容易忽略生成的氢气.

练习册系列答案
相关题目
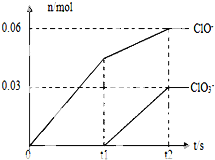 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、苛性钾溶液中KOH的物质的量是0.09mol |
| B、ClO3-的生成是由于氯气的量的多少引起的 |
| C、在酸性条件下,ClO-和ClO3-可生成Cl2 |
| D、反应中转移电子的物质的量是0.21mol |
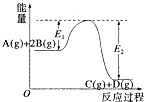 反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )
反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )| A、Q=E2 |
| B、在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
| C、Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 |
| D、1molA(g)和2molB(g)具有的能量比1molC(g)和1molD(g)具有的能量低 |
 图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )