题目内容
(1)反应aA (g)+bB (g)
Cc(g)(△H<0)在等容条件下进行.改变其他 反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示,请回答:
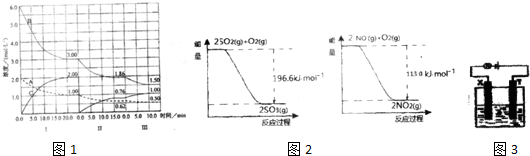
①该反应的化学方程式可表示为 ;
②A的平衡转化率ar(A)、a11(A)、aIII(A)中最小的是 ,其值是 (保留2位有效数字).
③由第一次平衡到第二次平衡,平衡移动的方向是 (填“向左”、“向右”或“不移动”),采取的措施是 .
④比较第Ⅱ阶段和第Ⅲ阶段反应温度的高低和平衡常数的关系:T2 T3、K2 K3(填“>”、“=”或“<”).
(2)2NO2有较强的氧化性,能将SO2氧化成SO3,本身被还原成NO,已知下列两个反应过程中能量变化如图2所示:则NO2氧化SO2的热化学方程式为 .
(3)若用如图3的电解池(X、Y均为惰性电极)电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生的气体672mL(标况)时,阴极析出的金属铜的质量是 ,溶液的pH= (假设电解后溶液体积不变).
| 催化剂 |

①该反应的化学方程式可表示为
②A的平衡转化率ar(A)、a11(A)、aIII(A)中最小的是
③由第一次平衡到第二次平衡,平衡移动的方向是
④比较第Ⅱ阶段和第Ⅲ阶段反应温度的高低和平衡常数的关系:T2
(2)2NO2有较强的氧化性,能将SO2氧化成SO3,本身被还原成NO,已知下列两个反应过程中能量变化如图2所示:则NO2氧化SO2的热化学方程式为
(3)若用如图3的电解池(X、Y均为惰性电极)电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生的气体672mL(标况)时,阴极析出的金属铜的质量是
考点:热化学方程式,化学平衡的影响因素,电解原理
专题:
分析:(1)①由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,根据浓度变化量之比等于化学计量数之比计算;
②转化率是物质的减少量与初始量的比值,计算三个阶段B的转化率,据此解答;
③由图可知第Ⅱ阶段各物质的物质的量的变化,可推知平衡移动的方向;
④第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;
(2)根据图示写出两个热化学方程式,根据盖斯定律将两个反应相加或相减以得到NO2(g)与SO2(g)生成SO3(g)和NO(g)的反应热,再书写热化学反应方程式;
(3)根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的c(H+),从而得出其pH.
②转化率是物质的减少量与初始量的比值,计算三个阶段B的转化率,据此解答;
③由图可知第Ⅱ阶段各物质的物质的量的变化,可推知平衡移动的方向;
④第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;
(2)根据图示写出两个热化学方程式,根据盖斯定律将两个反应相加或相减以得到NO2(g)与SO2(g)生成SO3(g)和NO(g)的反应热,再书写热化学反应方程式;
(3)根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的c(H+),从而得出其pH.
解答:
解:(1)①由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2,则方程式为:A (g)+3B (g)
2C(g),
故答案为:A (g)+3B (g)
2C(g);
②B的平衡转化率αⅠ(A)=
×100%=50%,αⅡ(A)=
×100%=38%,αⅢ(A)=
×100%=19.4%,故αⅠ(A)最大,αⅢ(A)=19.4%,
故答案为:αⅢ(A);19.4%;
③第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,
故答案为:向右;从反应体系中移出产物C;
④第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;此反应为放热反应,降低温度,平衡向正反应方向移动,则平衡常数变大,所以K2<K3;
故答案为:>;<;
(2)由图示得到以下两个方程式:
①2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,
②2NO(g)+O2(g) 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,
根据盖斯定律可知,
可得NO2(g)+SO2(g)═SO3(g)+NO(g),
则△H=
=-41.8kJ?mol-1,
故答案为:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1;
(3)电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=
×22.4L/mol=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+
=0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,只析出0.04mol的铜即0.04×64=2.56g,而阳极生成224mL氧气时,阳极附近同时生成C(H+)=
=0.1mol/L,所以溶液的pH=1,
故答案为:2.56g;1.
| 催化剂 |
故答案为:A (g)+3B (g)
| 催化剂 |
②B的平衡转化率αⅠ(A)=
| 1mol/L |
| 2mol/L |
| 1mol/L-0.62mol/L |
| 1mol/L |
| 0.62mol/L-0.5mol/L |
| 0.62mol/L |
故答案为:αⅢ(A);19.4%;
③第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,
故答案为:向右;从反应体系中移出产物C;
④第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;此反应为放热反应,降低温度,平衡向正反应方向移动,则平衡常数变大,所以K2<K3;
故答案为:>;<;
(2)由图示得到以下两个方程式:
①2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,②2NO(g)+O2(g)
 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,根据盖斯定律可知,
| ①-② |
| 2 |
则△H=
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
故答案为:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1;
(3)电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=
| 0.04mol |
| 2 |
| 0.224L |
| 22.4L/mol |
| ||
| 0.4L |
故答案为:2.56g;1.
点评:本题考查化学反应速率与化学平衡图象、化学平衡有关计算、盖斯定律的应用以及电解池的有关计算等知识点,难度较难,尤其是图象较为复杂,学生思路容易混乱;

练习册系列答案
相关题目
下列与有机物结构、性质相关的叙述错误的是( )
| A、用水可区分苯和溴苯 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
食品卫生与健康密切相关,下列做法会导致食品对人体有害的是( )
①有些食品加工厂将塑化剂添加到食品中
②石灰水保存鲜鸡蛋
③用“瘦肉精”(一种含激素的饲料)饲养生猪
④蒸馒头时加入适量纯碱.
①有些食品加工厂将塑化剂添加到食品中
②石灰水保存鲜鸡蛋
③用“瘦肉精”(一种含激素的饲料)饲养生猪
④蒸馒头时加入适量纯碱.
| A、①② | B、①③ | C、②③ | D、②④ |
N2H4是一种高效清洁的火箭燃料,0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
A、
| ||||||
| B、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1 | ||||||
| C、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ?mol-1 | ||||||
| D、N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ?mol-1 |
下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
| A、Na+、Ca2+、SO42-、Cl- |
| B、H+、Mg2+、CO32-、S2- |
| C、K+、Mg2+、SO42-、NO3- |
| D、K+、Na+、NO3-、SO32- |
将BaO2放入密闭真空容器中,反应2BaO2(s)═2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |
已知分解1mol H2O2放出热量98kJ.在含有少量I-的溶液中,H2O2分解的机理为:H2O2+I-→H2O+IO-H2O2+IO-→H2O+O2+I-.下列有关该反应的说法正确的是( )
| A、反应速率与I-浓度有关 |
| B、IO-也是该反应的催化剂 |
| C、反应活化能等于98kJ?mol-1 |
| D、v(H2O2)=v(H2O)=v(O2) |
工业上常用电解法冶炼的金属是( )
| A、Ag | B、Cu | C、Fe | D、Al |