题目内容
6.短周期主族元素A、B、C、D,原子序数依次增大.A.C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A>C | |
| C. | B和D最高价氧化物对应水化物相互不反应 | |
| D. | 单质B常温下能溶于浓硝酸 |
分析 A、C的原子序数的差为8,说明A、C同主族,结合三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,以此解答该题.
解答 解:A、C的原子序数的差为8,说明A、C同主族,结合三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素.
A、由于B、C、D同周期,原子序数依次增大,同一周期,从左到右半径在减小,原子半径B>C>D,D为氯元素,A为氧元素,原子半径为D>A,故原子半径为B>C>D>A,故A错误;
B、A、C同主族,自上而下金属性增强,非金属性减弱,所以非金属性A>C,故B正确;
C、B和D最高价氧化物对应水化物分别为氢氧化铝和高氯酸,二者发生中和反应,故C错误;
D、B为铝元素,常温下铝在浓硝酸钝化,不能溶解,故D错误.
故选B.
点评 本题考查学生利用原子的结构和位置来推断元素,为高考常见题型,侧重于学生的分析能力的考查,明确半径、金属性非金属性、最高价氧化物对应水化物的酸性的比较规律,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
16.化石燃料是最重要的能源之一.下列关于化石燃料的说法错误的是( )
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
14.有一瓶Na2SO3溶液,可能部分被氧化,某同学进行如下实验:取少量此溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入足量稀HCl,充分振荡后仍有白色沉淀,对此实验下列结论正确的是( )
| A. | 此溶液中Na2SO3已部分氧化? | |
| B. | 加入Ba(NO3)2溶液生成的沉淀一定含BaSO4? | |
| C. | 加HCl后的不溶沉淀一定为BaSO4? | |
| D. | 此样品未被氧化? |
1.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 25℃、101 kPa时,20 g SO3中含有的原子数目为NA | |
| C. | 1 L 1 mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA |
11.关于碱金属单质的性质叙述错误的是( )
| A. | 钠在空气中燃烧的生成物是过氧化钠 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 碱金属单质还原性随原子电子层数的增加而增加 |
18.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
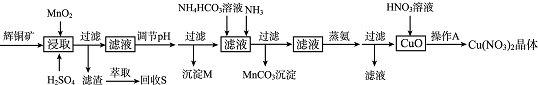
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0 kJ•mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l .
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(NO3)2.

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0 kJ•mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l .
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(NO3)2.
16.下列物质中能与NaOH溶液、Na2CO3、溴水、苯酚钠溶液和甲醇都反应的是( )
| A. | C6H6 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |