题目内容
11.关于碱金属单质的性质叙述错误的是( )| A. | 钠在空气中燃烧的生成物是过氧化钠 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 碱金属单质还原性随原子电子层数的增加而增加 |
分析 A.钠在空气中燃烧的生成过氧化钠;
B.碱金属性质活泼,都能够置换水中的氢气;
C.金属晶体原子半径越大熔沸点越低;
D.碱金属原子半径越大,失去电子的能力越强,金属性越强,单质还原性越强.
解答 解:解:A.钠在空气中燃烧的生成过氧化钠,而不是氧化物,故A正确;
B.碱金属性质活泼,都能够置换水中的氢气,故B正确;
C.碱金属随原子序数增加,原子半径增大,金属键越弱,熔沸点越低,故C错误;
D.碱金属随原子序数增加,电子层数的增加,失去电子的能力越强,金属性越强,单质还原性越强,故D正确;
故选:C.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题的关键,题目难度不大.

练习册系列答案
相关题目
1.已知反应4NH3+5O2=4NO+6H2O(g),下列表示的反应速率最大的是( )
| A. | V(NH3)=0.6mol/(L•S) | B. | V(O2)=0.7mol/(L•S) | C. | V(NO)=0.5mol/(L•S) | D. | V(H2O)=0.8mol/(L•S) |
2.下列试剂中,能用于检验酒精中是否含有水的是( )
| A. | 胆矾 | B. | 无水硫酸铜 | C. | 浓硫酸 | D. | 钠 |
19.下列说法中正确的是( )
| A. | 锌锰干电池是二次电池 | |
| B. | 铜片、锌片、导线和甜橙组成的水果电池,负极是铜片 | |
| C. | 铅蓄电池的放电过程,从能量转换形式看是化学能转化为电能 | |
| D. | 原电池工作时溶液中的阳离子移向负极 |
6.短周期主族元素A、B、C、D,原子序数依次增大.A.C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A>C | |
| C. | B和D最高价氧化物对应水化物相互不反应 | |
| D. | 单质B常温下能溶于浓硝酸 |
20.下列图示与对应的叙述不相符的是( )


| A. | 图甲表示在 2L 的密闭容器中发生合成氨反应时 N2 的物质的量随时间的变化曲线,从 11min 起其它条件不变,压缩容器的体积为 1L,则 n(N2)的变化曲线为 d | |
| B. | 图乙表示压强对可逆反应 2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变 | |
| D. | 图丁表示反应:I2(aq)+I-(aq)?I-3(aq)进行到状态 D 时一定有v 逆>v 正 |
 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
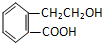 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
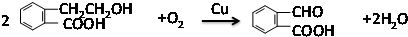 ;氧化反应;
;氧化反应; ;酯化反应;
;酯化反应; $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.