题目内容
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑧的原子结构示意图是
(2)比较①、②、③三者气态氢化物的稳定性由强到弱: > > (用氢化物的分子式表示)
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填“共价”或“离子”)化合物.
(4)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: .
(5)④、⑤、⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是 (要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: .
(7)写出⑥的最高价氧化物的水化物和⑤的最高价氧化物的水化物反应的化学方程式: .
(8)元素⑦和元素⑩相比,非金属性较强的是 (填元素符号);可以用一个置换反应来说明两者的非金属性强弱,其化学方程式是 .
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)比较①、②、③三者气态氢化物的稳定性由强到弱:
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:
(5)④、⑤、⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:
(7)写出⑥的最高价氧化物的水化物和⑤的最高价氧化物的水化物反应的化学方程式:
(8)元素⑦和元素⑩相比,非金属性较强的是
考点:元素周期律和元素周期表的综合应用
专题:
分析:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br;
(1)Ar为18号元素,核外有18个电子;
(2)同周期从左到右元素的非金属性逐渐增强,氢化物的稳定性增强;
(3)④与⑥的化合物为Na2S,为离子化合物;
(4)同周期从左到右元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,同主族从下到上元素的最高价氧化物的水化物酸性逐渐增强,碱碱性逐渐减弱,根据化合物中的化学键来书写电子式;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(6)氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸;
(7)氢氧化铝具有两性,可以和强酸反应生成盐和水;
(8)同主族元素从上到下非金属性减弱.
(1)Ar为18号元素,核外有18个电子;
(2)同周期从左到右元素的非金属性逐渐增强,氢化物的稳定性增强;
(3)④与⑥的化合物为Na2S,为离子化合物;
(4)同周期从左到右元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,同主族从下到上元素的最高价氧化物的水化物酸性逐渐增强,碱碱性逐渐减弱,根据化合物中的化学键来书写电子式;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(6)氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸;
(7)氢氧化铝具有两性,可以和强酸反应生成盐和水;
(8)同主族元素从上到下非金属性减弱.
解答:
解:根据元素周期表中元素的分布情况,知①为H,②为C,③为N,④为O,⑤为F,⑥为Na,⑦为Al,⑧为S,⑨为Cl,⑩为Ar.
(1)Ar为18号元素,核外有18个电子,其原子结构示意图为: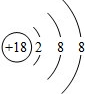 ,
,
故答案为: ;
;
(2)同周期从左到右元素的非金属性逐渐增强,氢化物的稳定性增强,则氢化物的稳定性:H2O>NH3>CH4,
故答案为:H2O;NH3;CH4;
(3)⑥为与第三周期、第ⅥA族,为S元素,形成的化合物为Na2S,为离子化合物,
电子式表示元素Na与S的化合物的形成过程为: ,
,
故答案为: ;离子;
;离子;
(4)同周期从左到右元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,同主族从下到上元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,所以酸性最强的是高氯酸HClO4,碱性最强的元素对应的金属的金属性最强,应为④,即K元素,对应的碱为KOH,为离子化合物,其电子式为 ,
,
故答案为:HClO4; ;
;
(5)④、⑤、⑥、⑦三种元素形成的简单离子分别为Na+、Al3+、S2-、Cl-,具有相同的核外电子数,核内质子数越多,半径越小,电子层越多离子半径越大,所以半径大小顺序为:S2->Cl->Al3+>Na+,
故答案为:S2->Cl->Al3+>Na+;
(6)氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸,则反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(7)铝的最高价氧化物的水化物是氢氧化铝,硫的最高价氧化物的水化物是硫酸,属于强酸,氢氧化铝具有两性,可以和强酸反应生成盐和水,实质是:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,
故答案为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;
(8)⑦为Cl,⑩为Br,同主族元素从上到下非金属性减弱,则Cl的非金属性强,可利用单质间的置换反应来验证,氯气和NaBr溶液反应生成溴单质,所以据此能证明氯元素的非金属性比溴元素强,
故答案为:Cl;Cl2+2NaBr=2NaCl+Br2.
(1)Ar为18号元素,核外有18个电子,其原子结构示意图为:
 ,
,故答案为:
 ;
;(2)同周期从左到右元素的非金属性逐渐增强,氢化物的稳定性增强,则氢化物的稳定性:H2O>NH3>CH4,
故答案为:H2O;NH3;CH4;
(3)⑥为与第三周期、第ⅥA族,为S元素,形成的化合物为Na2S,为离子化合物,
电子式表示元素Na与S的化合物的形成过程为:
 ,
,故答案为:
 ;离子;
;离子;(4)同周期从左到右元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,同主族从下到上元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,所以酸性最强的是高氯酸HClO4,碱性最强的元素对应的金属的金属性最强,应为④,即K元素,对应的碱为KOH,为离子化合物,其电子式为
 ,
,故答案为:HClO4;
 ;
;(5)④、⑤、⑥、⑦三种元素形成的简单离子分别为Na+、Al3+、S2-、Cl-,具有相同的核外电子数,核内质子数越多,半径越小,电子层越多离子半径越大,所以半径大小顺序为:S2->Cl->Al3+>Na+,
故答案为:S2->Cl->Al3+>Na+;
(6)氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸,则反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(7)铝的最高价氧化物的水化物是氢氧化铝,硫的最高价氧化物的水化物是硫酸,属于强酸,氢氧化铝具有两性,可以和强酸反应生成盐和水,实质是:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,
故答案为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;
(8)⑦为Cl,⑩为Br,同主族元素从上到下非金属性减弱,则Cl的非金属性强,可利用单质间的置换反应来验证,氯气和NaBr溶液反应生成溴单质,所以据此能证明氯元素的非金属性比溴元素强,
故答案为:Cl;Cl2+2NaBr=2NaCl+Br2.
点评:本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置及元素、化合物的性质是解答本题的关键,题目难度中等,注意化学用语的使用来解答.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
| A、稀盐酸和Na2CO3溶液 |
| B、稀盐酸和AgNO3溶液 |
| C、AlCl3溶液和NH3?H2O溶液 |
| D、Ba(OH)2溶液和NaHCO3溶液 |
下列与有机物结构、性质相关的叙述错误的是( )
| A、用水可区分苯和溴苯 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如表,据此,将乙二醇和丙三醇互相分离的方法是( )
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
| A、萃取法 | B、过滤法 |
| C、分液法 | D、蒸馏法 |
下列各项中的事实能用同一原理解释的是( )
| A、明矾和氯水都用于自来水的处理 |
| B、.干冰和碘化银都可用于人工降雨 |
| C、向Fe(OH)3胶体和NaAlO2溶液中逐滴加盐酸,先出现沉淀,然后溶解 |
| D、铁器和铝制容器都可以用来运输浓硫酸 |
将BaO2放入密闭真空容器中,反应2BaO2(s)═2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |
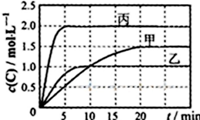 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g). 化合物Ⅱ的分子式为
化合物Ⅱ的分子式为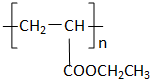 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为