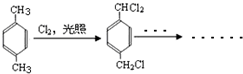
题目内容
11.某烃含碳、氢原子物质的量之比为1:2,该烃对氮气的相对密度为2,该烃可使溴水褪色,该烃的二氯代物有四种同分异构体,该烃为( )| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
分析 根据相对密度确定该烃相对分子质量,结合碳、氢原子物质的量之比,进而确定分子式,可使溴水褪色,说明含有双键或三键,从而确定烃的结构简式,先根据烃的结构简式写出一氯代物的种类,然后根据一氯代物中的种类来确定二氯代物的种类,据此解答;
解答 解:该烃对氮气的相对密度为2,则相对分子质量=28×2=56,含碳、氢原子物质的量之比为1:2,最简式为CH2,分子式为(CH2)2,即14n=56,解得:n=4,所以该烃的分子式为C4H8,该烃可使溴水褪色,说明含有碳碳双键,结构简式有:CH2=CHCH2CH3、CH3CH=CHCH3、 ,
,
CH2=CHCH2CH3有4种一氯代物,然后以一氯代物为基础再添上一个氯,可得二氯代物,共有9种;
CH3CH=CHCH3有2种一氯代物,然后以一氯代物为基础再添上一个氯,可得二氯代物,共有5种; 有2种一氯代物,然后以一氯代物为基础再添上一个氯,可得二氯代物,共有4种;
有2种一氯代物,然后以一氯代物为基础再添上一个氯,可得二氯代物,共有4种;
故选D.
点评 考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
2.现有两份质量都为13.8gNa、12gMg、10.8gAl的金属混合物,其中一份加入到1mol/L、200ml的稀硫酸中,另一份加入到1mol/L、200ml的氢氧化钠溶液中,则两溶液中产生的H2在标准状况下的体积比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 5:6 |
6.某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,核磁共振氢谱显示该分子中有4个吸收锋,则该有机物的结构简式是( )
| A. | CH3CH(OH)CH3 | B. | CH3CH2CH2CH2OH | C. | CH3CH2CH2OH | D. | CH3CH2OCH2CH3 |
16.下列说法正确的是( )
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
3.某微粒的核外电子排布式为1s22s22p6,下列说法不正确的是( )
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素的单质可能是强还原剂 | |
| C. | 对应元素可能是电负性最大的元素 | |
| D. | 对应元素可能位于元素周期表中第13列 |
20.卤族元素的单质和化合物很多,我们可以利用所学《物质结构与性质》的相关知识去认识和理解它们.
(1)卤族元素都位于元素周期表的p区(填“s”、“p”、“d”或“ds”).
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写元素名称).
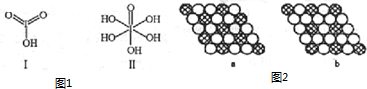
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1中Ⅰ、Ⅱ所示:
请比较二者酸性的强弱:HIO3>H5IO6(填“>”、“<”或“=”).
(5)如图2所示的二维平面晶体示意图中表示化学式为AX3的是b.(填字母)
(1)卤族元素都位于元素周期表的p区(填“s”、“p”、“d”或“ds”).
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写元素名称).
| 卤族元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |

(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1中Ⅰ、Ⅱ所示:
请比较二者酸性的强弱:HIO3>H5IO6(填“>”、“<”或“=”).
(5)如图2所示的二维平面晶体示意图中表示化学式为AX3的是b.(填字母)
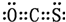 ;碳原子核外电子的轨道表达式为
;碳原子核外电子的轨道表达式为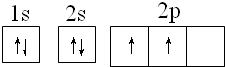 .
.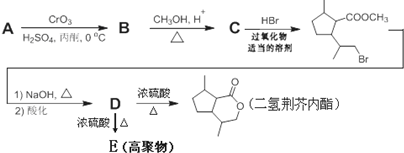
 ,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.
,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.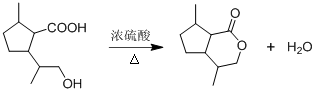 .
. .
. ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.