题目内容
1.H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
| A. | M室发生的电极反应式为:2H2O-4e-=O2↑+4H+ | |
| B. | N室中:a%<b% | |
| C. | b膜为阴离子交换膜 | |
| D. | 理论上每生成1mol产品,阴极室可生成5.6L气体 |
分析 A.M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+;
B.N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大;
C.原料室中的B(OH)4-通过b膜进入产品室;
D.理论上每生成1mol产品,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成1molH+、N室生成0.5molH2.
解答 解:A.M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-═O2↑+4H+,故A正确;
B.N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室:a%<b%,故B正确;
C.原料室中的B(OH)4-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,则b膜为阴离子交换膜,故C正确;
D.理论上每生成1mol产品,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成1molH+、N室生成0.5molH2,阴极生成的气体体积在标况下是11.2L,故D错误;
故选D.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,注意离子交换膜类型的判断方法,选项D为解答的易错点,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
13.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 3 Cl2+6 FeI2=2FeCl3+4 FeI3 | B. | 3Cl2+2FeI2=2FeCl3+2I2 | ||
| C. | Co2O3+6 HCl=2CoCl2+Cl2↑+3H2O | D. | 2FeCl3+2HI=2FeCl2+I2+2HCl |
12.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和CH2═CH-CH3 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 苯和硝基苯采用分液的方法分离 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
9.下列说法正确的是( )
| A. | 对于吸热反应,反应物所具有的总能量总是高于生成物所具有的总能量 | |
| B. | 放热反应在常温条件下不一定能发生反应 | |
| C. | 形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
16.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高氧化物对应的水化物能相互反应 |
13.下列实验所选装置不合理的是( )

| A. | 用④分离NaCl溶液和花生油 | B. | 用③分离CCl4和水 | ||
| C. | 用⑤吸收CO2 | D. | 用①和②进行粗盐提纯 |
10.下列用洗净的废铜屑制备硝酸铜的方案中,能节约原料和防止环境污染的是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{加热}^{空气}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$→_{加热}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
6.CO2的转换在生产、生活中具有重要的应用.
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”.
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为HCO3-、CO32-.
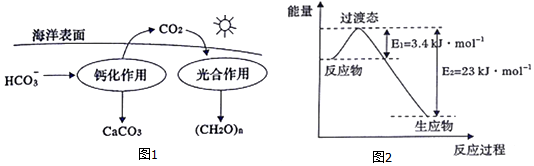
②在海洋碳循环中,可通过图1所示的途径固碳.写出钙化作用的离子方程式:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C.放电时,在正极得电子的物质为CO2;充电时,阳极的反应式为C-4e-+2CO32-═3CO2.
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气.图2表示恒压容器中0.5molCO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据B、D(填字母).
A.容器中压强不变 B.H2的体积分数不变
C.c(H2=3c(CH3OH) D.容器中密度不变
E.2个C=O断裂的同时有6个H-H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
①实验2条件下平衡常数K=$\frac{1}{6}$.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值<1 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正<v(逆)(填“<”、“>”或“=“).
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(I)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”.
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为HCO3-、CO32-.
②在海洋碳循环中,可通过图1所示的途径固碳.写出钙化作用的离子方程式:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C.放电时,在正极得电子的物质为CO2;充电时,阳极的反应式为C-4e-+2CO32-═3CO2.
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气.图2表示恒压容器中0.5molCO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据B、D(填字母).

A.容器中压强不变 B.H2的体积分数不变
C.c(H2=3c(CH3OH) D.容器中密度不变
E.2个C=O断裂的同时有6个H-H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值<1 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正<v(逆)(填“<”、“>”或“=“).
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(I)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.



