题目内容
8.加碘盐中的含碘物质为碘酸钾(KIO3),其摩尔质量为214g/mol;我国规定,每千克加碘盐含碘元素0.035g,相当于每吨加碘盐含碘酸钾2.80×10-1mol(精确至小数点后两位)分析 摩尔质量单位以g/mol时,数值上等于其相对分子质量,结合n=$\frac{m}{M}$计算解答;
解答 解:加碘盐中的含碘物质为碘酸钾(KIO3),KIO3式量为214,所以碘酸钾摩尔质量为:214g/mol;设每千克食盐中含KIO3(碘酸钾)的质量为x,依据题意可知:0.035g:x=127:214;
x=0.06g,物质的量为:$\frac{0.06g}{214g/mol}$=2.80×10-4mol,则1t加碘盐含碘酸钾物质的量为2.80×10-4mol×1000=2.80×10-1mol;
故答案为:214g/mol;2.80×10-1;
点评 本题考查了以物质的量为核心的有关计算,明确摩尔质量的概念,熟悉n=$\frac{m}{M}$是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在标准状况下,与32gO2的体积相等的N2为( )
| A. | 质量为14g | B. | 分子数为6.02×1023 | ||
| C. | 体积为11.2L | D. | 物质的量为2mol |
3.工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出.下列说法错误的是( )
| A. | 氧化性:H2SeO4>Cl2H2SeO3>H2SO4 | |
| B. | 在SO2与亚硒酸的反应中,1mol H2SeO3参加反应转移4mol e- | |
| C. | 析出1mol硒需要消耗标准状况下22.4 L SO2 | |
| D. | 亚硒酸既有氧化性,又有还原性 |
13.水溶液中下列电离方程式书写正确的是( )
| A. | Ca(OH)2?Ca2++2OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO3?2H++SO32- | D. | BaSO4═Ba2++SO42- |
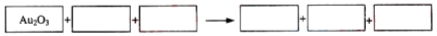

 与氧化剂物质的量之比为__________。
与氧化剂物质的量之比为__________。