题目内容
10.选择下列实验方法分离物质,将分离方法的序号填在横线上.A、萃取分液法 B、加热分解C、结晶法D、分液法E、蒸馏法F、过滤法
(1)F分离饱和食盐水和沙子的混合物;
(2)C从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)D分离水和苯的混合物;
(4)E分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)
(5)B分离碳酸钠中的碳酸氢钠
(6)A从碘的饱和水溶液中分离出碘.
分析 (1)沙子不溶于水,食盐溶于水;
(2)硝酸钾和氯化钠的溶解度受温度影响不同;
(3)水和苯分层;
(4)四氯化碳和甲苯互溶,但沸点不同;
(5)碳酸氢钠加热分解生成碳酸钠;
(6)碘不易溶于水,易溶于有机溶剂.
解答 解:(1)沙子不溶于水,食盐溶于水,则选择过滤法分离,故答案为:F;
(2)硝酸钾和氯化钠的溶解度受温度影响不同,则选择结晶法分离,故答案为:C;
(3)水和苯分层,则选择分液法分离,故答案为:D;
(4)四氯化碳和甲苯互溶,但沸点不同,则选择蒸馏法分离,故答案为:E;
(5)碳酸氢钠加热分解生成碳酸钠,则加热分解可除杂,故答案为:B;
(6)碘不易溶于水,易溶于有机溶剂,则选择萃取、分液分离,故答案为:A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
9.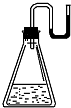 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
10.图中,表示正反应是吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列反应的离子方程式正确的是( )
| A. | 向银氨溶液中加入足量氢溴酸溶液:Ag(NH3)2++OHˉ+3H+═Ag++2NH4++H2O | |
| B. | 向0.1 mol/L pH=1的NaHA的溶液中加入NaOH溶液:HA-+OH-═H2O+A2- | |
| C. | H2C2O4使酸性KMnO4溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:2Ba2++2SO42-+4OH-+Al3+═2BaSO4↓+AlO2-+2H2O |
15.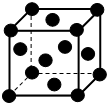 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )| A. | 该晶体与氯化钠的晶体类型相同 | |
| B. | 该晶体熔化只需要破坏共价键 | |
| C. | SiH4分子的稳定性强于甲烷 | |
| D. | 每个顶点的甲烷与之距离最近的甲烷分子有12个 |
2.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝和盐酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
19.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 验证电离H+的能力HClO>HCO3- | 向 NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴84消毒液,观察红色褪色的快慢 | 证明随溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 常温常压下,22.4 LCCl4含有NA个CCl4分子 | |
| C. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g N2O4和NO2的混合气体中,含有NA个氧原子 |