题目内容
19.铁和铝是两种重要的常见金属.请回答:(1)将烧得红热的铁丝伸到盛有氯气的集气瓶中,可观察到有棕黄色的烟生成.该反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(2)常温下,将铁、铝放入浓硝酸中,可发生钝化现象,这是由于浓硝酸具有氧化性.
(3)下列反应中,可用于焊接钢轨的是②(填序号).
①3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2
②2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3
③3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2
(4)在空气中,FeCl2溶液滴加NaOH溶液,先产生白色沉淀,后变灰绿色,最后显红褐色的原因是:Fe(OH)2能够非常迅速地被空气中氧气氧化成红褐色Fe(OH)3.
(5)在两支试管里分别加入5mL FeCl2溶液和5mL FeCl3溶液,各滴入几滴KSCN溶液,可观察到溶液变为红色现象的是氯化铁(填写名称)溶液.
分析 (1)氯气具有强氧化性,氧化变价金属市场高价化合物,氯气和铁反应生成氯化铁;
(2)浓硝酸具有强氧化性,可在常温下与铝、铁发生钝化反应;
(3)可用于焊接钢轨需要反应放热生成的金属呈熔融状态;
(4)在空气中迅速变为灰绿色,最后变为红褐色,是Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3;
(5)三价铁离子遇到KSCN溶液会生成血红色溶液,是铁离子的检验方法.
解答 解:(1)将烧得红热的铁丝伸到盛有氯气的集气瓶中,可观察到有棕黄色的烟生成,产物为氯化铁固体,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(2)金属钝化的实质是金属被浓硫酸、浓硝酸氧化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸、浓硝酸.,铁、铝在常温下与浓硝酸发生钝化,是因为浓硝酸具有强氧化性,在金属的表面生成一层致密的氧化物膜,阻碍反应的继续进行,
故答案为:氧化;
(3)①3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2,反应在高温下进行生成铁,但在野外条件下难于实现反应,
②2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 ,氯和氧化铁反应是放热反应,放出的热量使生成的铁呈熔融状态,可以焊接钢轨,
③3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2 ,反应是吸热反应,不能焊接钢轨,
故答案为:②;
(4)在空气中迅速变为灰绿色,最后变为红褐色,是Fe(OH)2遇到空气中的氧气,会被氧气氧化成Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:空气中氧气;
(5)在两支试管里分别加入5mL FeCl2溶液和5mL FeCl3溶液,各滴入几滴KSCN溶液,可观察到溶液变为红色现象的是氯化铁溶液,Fe3++3SCN-=Fe(SCN)3,
故答案为:氯化铁.
点评 本题考查了元素化合物性质的分析应用,主要是铁及其化合物、浓硝酸、金属冶炼、铝热反应、离子检验等知识的理解应用,掌握基础是解题关键,题目难度不大.

| A. | 苯 | B. | 乙烯 | C. | 甲烷 | D. | 聚乙烯 |
| A. | 电解法:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| B. | 热还原法:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 | |
| C. | 热分解法:2Al2O3═4Al+3O2↑ | |
| D. | 物理方法:利用密度大的性质水洗矿物提取金 |
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
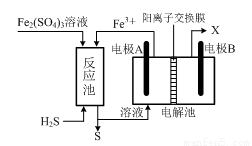
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。

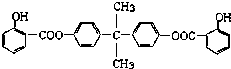
 +n HOCH2CH2OH$\stackrel{一定条件}{→}$
+n HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. .
.

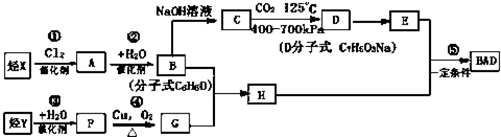
 .
. .F+E
.F+E .
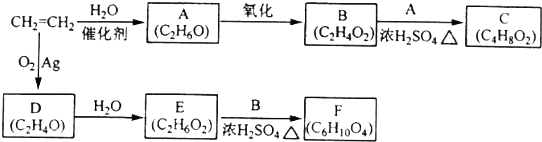
.
 ;
;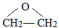 ;
;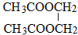 ;
;