题目内容
20.(1)若NA为阿伏伽德罗常数,则3.4g氨气中所含氢原子个数为0.6NA.(2)约3.01×1023个OH-的质量为8.5g,含有电子的物质的量为,这些OH-与0.5mol NH3的质量相同.
(3)28g KOH固体必须溶解在1800g水中,才能使每200个水分子中有1个K+,所得溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为0.27ρ mol/L.(保留到小数点后两位)
分析 (1)根据n=$\frac{m}{M}$计算出氨气的物质的量,再根据N=nNA计算出含有氨气分子含有的氢原子数目;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$,结合氢氧根离子、氨气都是10电子微粒;
(3)n(KOH)=$\frac{28g}{56g/mol}$=0.5mol,要使每200个水分子中有1个K+,则水的物质的量与KOH的物质的量之比为200:1,再根据m=nM计算水的质量;根据c=$\frac{1000ρω}{M}$计算溶解后氢氧根离子的物质的量浓度.
解答 解:(1)氨气的相对分子质量是17,其摩尔质量是17g/mol,则3.4g氨气的物质的量为:n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,所以含有氨气的分子数为:N(NH3)=nNA=0.2×NA=0.2NA,含有氢原子的数目为:N(H)=3N(NH3)=0.6NA,
故答案为:0.6NA;
(2)约3.01×1023个OH-的物质的量为:$\frac{3.01×10{\;}^{23}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=0.5mol,质量为0.5mol×17g/mol=8.5g;含有电子的物质的量为0.5mol×10=5mol;8.5g氨气的物质的量为$\frac{8.5g}{17g/mol}$=0.5mol;
故答案为:8.5g;5mol;0.5mol;
(3)28g KOH的物质的量为$\frac{28g}{56g/mol}$=0.5mol,每200个水分子中有1个K+,则水的物质的量为0.5mol×200=100mol,则水的质量为100mol×18g/mol=1800g,
c=$\frac{1000ρω}{M}$=$\frac{1000ρ\frac{28}{28+1000}×100%}{56}$=0.27ρmol/L,
故答案为:1800;0.27ρmol/L.
点评 本题考查物质的量的计算,注意有关溶液的组成计算,题目难度不大,注意理解掌握物质的量浓度与质量分数之间关系.

| A. | 物质的量就是指物质的多少 | |
| B. | 原子、电子、中子、桌子等都可用物质的量来描述 | |
| C. | 物质的量是用来描述微观粒子的基本单位之一 | |
| D. | 物质的量是以摩尔为单位计量微粒数目的物理量 |
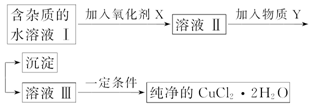
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.
| A. | 摩尔是国际七个基本物理量之一 | |
| B. | 含NA个O原子的O2物质的量为0.5mol | |
| C. | 6.02×1023个任何物质的量均为1mol | |
| D. | 1mol氢含有6.02×1023个氢 |
| A. | 海水分解 | |
| B. | 温度升高,其他溶质的溶解度增大 | |
| C. | 升高温度,降低食盐在水中的溶解度 | |
| D. | 利用阳光、风力蒸发水分使氯化钠成晶体析出 |
| A. | H2 | B. | Cl2 | C. | NO | D. | NO2 |