题目内容
19.2g的铜完全溶解在某浓度的硝酸中,生成8.96L(标准状况)的气体
求:(1)被还原的硝酸的物质的量;
(2)参加反应硝酸的物质的量.
求:(1)被还原的硝酸的物质的量;
(2)参加反应硝酸的物质的量.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)8.96L(标准状况)的气体至少为NO、NO2中的一种,可能为二者混合物,被还原的硝酸生成氮的氧化物气体,根据N原子守恒计算;
(2)反应中硝酸起酸性及氧化剂作用,起酸性作用的硝酸生成硝酸铜,起氧化剂作用的硝酸生成气体,根据N原子守恒计算.
(2)反应中硝酸起酸性及氧化剂作用,起酸性作用的硝酸生成硝酸铜,起氧化剂作用的硝酸生成气体,根据N原子守恒计算.
解答:
解:(1)8.96L(标准状况)的气体的物质的量=
=0.4mol,该气体至少为NO、NO2中的一种,可能为二者混合物,被还原的硝酸生成氮的氧化物气体,N原子守恒可知被还原的硝酸为0.4mol,
答:被还原的硝酸的物质的量为0.4mol.
(2)反应中硝酸起酸性及氧化剂作用,起酸性作用的硝酸生成硝酸铜,由Cu在守恒可知n[Cu(NO3)2]=n(Cu)=
=0.3mol,起氧化剂作用的硝酸生成气体,根据N原子守恒,参加反应硝酸的物质的量=n(气体)+2n[Cu(NO3)2]=0.4mol+2×0.3mol=1mol,
答:参加反应硝酸的物质的量为1mol.
| 8.96L |
| 22.4L/mol |
答:被还原的硝酸的物质的量为0.4mol.
(2)反应中硝酸起酸性及氧化剂作用,起酸性作用的硝酸生成硝酸铜,由Cu在守恒可知n[Cu(NO3)2]=n(Cu)=
| 19.2g |
| 64g/mol |
答:参加反应硝酸的物质的量为1mol.
点评:本题考查氧化还原反应计算,注意利用原子守恒计算,避免判断气体的成分,难度中等.

练习册系列答案
 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
能说明X的非金属性比Y的强的是( )
| A、与H2化合时X单质比Y单质容易 |
| B、X的最高价氧化物的水化物的碱性比Y的最高价氧化物的水化物的碱性强 |
| C、X原子的最外层电子数比Y原子的最外层电子数多 |
| D、X单质不可以把Y从其氢化物中置换出来 |
下列叙述中正确的是( )
| A、由水电离的c(OH-)=1×10-12mol/L的溶液中:Ba2+、K+、Br-、SiO32-一定能大量共存 |
| B、向氯化铝溶液中加入过量的氨水离子方程式是:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
| D、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
下列说法正确的是( )
| A、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| B、温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 |
| C、8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
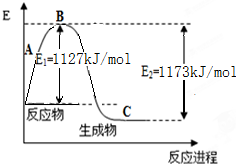 氨气是一种重要的化工原料,工业上用N2和H2合成NH3.现已知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图如图.回答下列问题:
氨气是一种重要的化工原料,工业上用N2和H2合成NH3.现已知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图如图.回答下列问题: