题目内容
16.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
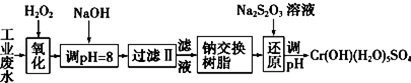
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
分析 I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,注意不能引入新的杂质;
(2)根据表中数据判断;通过钠离子交换树脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,结合得失电子守恒和原子守恒写出离子方程式;
II.(1)铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,据此书写方程式;
(3)根据溶度积常数以及水的离子积常数来进行计算.
解答 解:I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;
故答案为:AB;CD;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,则反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,
故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$=10-9 mol/L,c(H+)=$\frac{10{\;}^{-14}}{10{\;}^{-9}}$=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
点评 本题考查了物质分离提纯的操作及方法应用、电解原理、难溶物溶度积的计算等,题目难度较大,涉及的知识点较多,注意掌握电解原理、难溶物溶度积的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.

| A. | 在含3.2amolHNO3的稀溶液中,加入2amol铁粉:5Fe+4NO3-+16H+═3Fe2++2Fe3++4NO↑+8H2O | |
| B. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| C. | 泡沫灭火器灭火时发生的反应:2Al3++3CO32-+H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 将AgCl白色沉淀加入Na2S溶液中反应:2AgCl+S2-═Ag2S↓+2Cl- |
| A. | 烧杯 | B. | 量筒 | C. | 试管 | D. | 酒精灯 |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放
入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无 色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是据酸式滴定管用蒸馏水洗净后,应用标准液润洗
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |

| A. | 用图甲所示装置先放出水相,再放出有机相 | |
| B. | 用图乙所示装置制取少量氯气 | |
| C. | 用图丙所示装置蒸发浓缩FeCl3溶液制备纯净的FeCl3•6H2O | |
| D. | 用图丁所示装置验证光亮的铁钉在食盐水中可发生吸氧腐蚀 |
| A. | 发生化学反应时,旧化学键的断裂,一定会吸收能量 | |
| B. | ∑E(反应物)>∑E(生成物)--放出能量 (其中∑E表示总能量) | |
| C. | 有能量变化的化学反应遵守质量守恒定律,但不遵守能量守恒定律 | |
| D. | 一般情况下氧化、燃烧反应都是放热反应 |
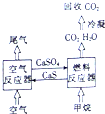 我国的能源主要来源于燃煤,煤燃烧产生的烟气直接排放会引起严重的环境问题.将烟气通过石灰石浆液的脱硫装置可以除去85%~90%的SO2,且最终会生成硫酸钙,将硫酸钙与甲烷通过循环燃烧装置的燃料反应器进行反应,生产出几乎不含杂质的二氧化碳,减少碳排放,其装置如图所示.
我国的能源主要来源于燃煤,煤燃烧产生的烟气直接排放会引起严重的环境问题.将烟气通过石灰石浆液的脱硫装置可以除去85%~90%的SO2,且最终会生成硫酸钙,将硫酸钙与甲烷通过循环燃烧装置的燃料反应器进行反应,生产出几乎不含杂质的二氧化碳,减少碳排放,其装置如图所示.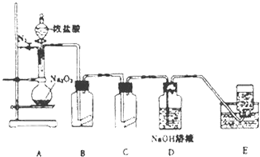 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置: