题目内容
相同温度下,在体积相同的两个密闭容器内充入等质量的CO2和SO2气体,则下列说法中正确的是( )
| A、CO2和SO2的物质的量相同 |
| B、CO2和SO2的密度比为11:16 |
| C、CO2和SO2的压强比为16:11 |
| D、CO2和SO2中所含氧原子的个数比为1:1 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.结合n=
分析;
B.体积相同,质量相同,结合ρ=
分析;
C.由pV=
RT可知,M与p成反比;
D.结合n=
及分子构成计算原子个数比.
| m |
| M |
B.体积相同,质量相同,结合ρ=
| m |
| V |
C.由pV=
| m |
| M |
D.结合n=
| m |
| M |
解答:
解:A.由n=
可知,CO2和SO2的摩尔质量分别为44g/mol、64g/mol,则物质的量不相同,故A错误;
B.体积相同,质量相同,由ρ=
可知,密度相同,故B错误;
C.由pV=
RT可知,M与p成反比,则CO2和SO2的压强比为64g/mol:44g/mol=16:11,故C正确;
D.由n=
及分子构成可知氧原子个数比等于物质的量比,均为
:
=16:11,故D错误;
故选C.
| m |
| M |
B.体积相同,质量相同,由ρ=
| m |
| V |
C.由pV=
| m |
| M |
D.由n=
| m |
| M |
| 1 |
| 44 |
| 1 |
| 64 |
故选C.
点评:本题考查阿伏伽德罗定律及应用,为高频考点,把握物质的量计算及阿伏伽德罗定律为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
在加入铝粉能放出氢气的无色溶液中,分别加入下列各组离子,可能大量共存的是( )
| A、Ca2+、NO3-、CO32-、Na+ |
| B、Na+、Mg2+、HCO3- |
| C、NO3-、Cu2+、K+、Cl- |
| D、NO3-、K+、Ba2+、OH- |
自然资源缺乏的形势日益严峻,地球的海水总量约为1.4×1018t,是人类最大的资源库.电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图,则( )

| A、大海中的海水可以直接通入到装置中进行淡化处理 |
| B、从Ⅰ口排出的是淡水 |
| C、该装置产生的浓水可以直接排放 |
| D、A接正极,a室应为阳极室,B接负极,b室应为阴极室 |
下列离子方程式正确的是( )
| A、向氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
| B、将Al条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ |
| C、向NaHSO4溶液中滴加Ba(OH)2溶液至恰好为中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、澄清石灰水与盐酸反应:Ca(OH)2+2H+═2H2O+Ca2+ |
下列实验中,不会产生沉淀的是( )
| A、CO2通入水玻璃中 |
| B、CO2 通入偏铝酸钠溶液中 |
| C、SO2通入氯化钡溶液中 |
| D、SO2通入氢氧化钙溶液中 |
下列不能由单质直接化合而成的物质是( )
| A、FeCl2 |
| B、CuCl2 |
| C、AlCl3 |
| D、NaCl |
以下物质间的每步转化通过一步反应就能实现的是( )
| A、Al→Al2O3→Al(OH)3→NaAlO2 |
| B、Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
| C、N2→NO→NO2→HNO3 |
| D、S→SO3→H2SO4→MgSO4 |
下列实验现象或反应,不是由于发生取代反应而引起的是( )
| A、乙酸与乙醇在浓硫酸作用下加热反应 |
| B、苯和浓硝酸、浓硫酸在50-60℃水浴中加热反应 |
| C、硬脂酸甘油酯在碱性条件下水解得到甘油和肥皂 |
| D、乙烯通入溴的四氯化碳溶液中,溶液褪色 |
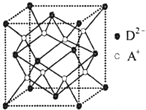 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题: