题目内容
15.在常温下,把氨水滴加到盐酸中,当c(NH+4)=c(Cl-)时,下列叙述中正确的是( )| A. | 混合溶液的pH等于7 | B. | 混合溶液的pH大于7 | ||
| C. | 加入酸碱的物质的量相等 | D. | 混合溶液还能再中和盐酸 |
分析 任何电解质溶液中都存在电荷守恒,根据电荷守恒及已知条件确定溶液中氢离子和氢氧根离子浓度相对大小,从而确定溶液酸碱性.
解答 解:A、任何电解质溶液中都存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),因为c(NH4+)=c(Cl-),则c(H+)=c(OH-),所以溶液呈中性,pH=7,故A正确;
B、任何电解质溶液中都存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),因为c(NH4+)=c(Cl-),则c(H+)=c(OH-),所以溶液呈中性,pH=7,故B错误;
C、若酸碱的物质的量相等,则恰好完全反应生成氯化铵溶液,水解显酸性,即c(H+)>c(OH-),故有c(NH4+)<c(Cl-),故C错误;
D、所得的混合溶液显中性,故氨水和盐酸混合后氨水过量,故还能再中和盐酸,故D正确.
故选AD.
点评 本题以溶液酸碱性判断考查了离子浓度大小比较,利用守恒思想分析解答,注意:温度未知时,不能根据溶液的PH确定溶液酸碱性,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.常温下,下列各溶液的叙述中正确的是( )
| A. | 0.10 mol•L-1的醋酸钠溶液20mL与0.10 mol•L-1盐酸10mL混合后溶液显酸性:c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) | |
| B. | pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)=c (H+)=c(OH-) | |
| C. | 若0.10 mol•L-1的醋酸的pH=a,0.010 mol•L-1的醋酸的pH=b,则a+1>b | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
20.下列有机物命名错误的是( )
| A. | CH3CHClCH2CH3 2-氯丁烷 | B. | CH3COOC2H5 乙酸乙酯 | ||
| C. | CH3CH2CH (CH3)2 2-甲基丁烷 | D. | 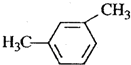 2,5-二甲苯 2,5-二甲苯 |
7.利用金属活性的不同,可以采取不同的冶炼方法冶炼金属.下列反应所描述的冶炼方法不可能实现的是( )
| A. | 2Al2O3(熔融) $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| C. | Fe+CuSO4═FeSO4+Cu | |
| D. | 2NaCl(水溶液)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ |
4.在探究SO2性质的实验中,下列说法正确的是( )
| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | 将SO2通入BaCl2 溶液中至饱和,无沉淀产生,再通入Cl2,产生白色沉淀 | |
| C. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O