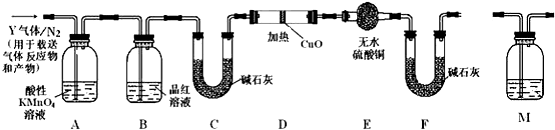
题目内容
12. 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.(1)该电池工作时,b口通入的物质为CH3OH,c口通入的物质为O2.
(2)该电池负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
(3)工作一段时间后,当6.4g甲醇完全反应生成CO2时,有1.2NA个电子转移.
(4)若将a口排放出的1.12L气体,通入到5L0.015mol•L-1NaOH溶液中完全反应.反应后的溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 (1)根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
(2)负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)根据甲醇和转移电子之间的关系式计算;
(4)标准状况下1.12LLCO2的物质的量为0.05mol,5L0.015mol•L-1NaOH溶液中含有0.075molNaOH,二者恰好发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,反应后生成了等浓度的碳酸钠和碳酸氢钠,然后结合盐的水解原理判断各离子浓度大小.
解答 解:(1)据氢离子移动方向知,右侧电极为正极,正极上氧气得电子,左侧电极为负极,负极上通入燃料甲醇,
故答案为:CH3OH;O2;
(2)负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(3)根据CH3OH-6e-+H2O=CO2+6H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=$\frac{6.4g}{32g/mol}$=0.2mol,则转移电子个数为1.2NA,
故答案为:1.2;
(4)标准状况下1.12LLCO2的物质的量为0.05mol,5L0.015mol•L-1NaOH溶液中含有0.075molNaOH,二者恰好发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,生成等浓度的Na2CO3、NaHCO3,HCO3-、CO32-部分水解,溶液呈碱性,则c(OH-)>c(H+),由于CO32-水解程度大于HCO3-,则c(HCO3-)>c(CO32-),所以反应后溶液中的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查了原电池原理,根据正负极上得失电子及反应物和转移电子之间的关系式解答,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,难度不大.

| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Na2O2和足量CO2反应转移2 NA个电子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
| A. | 48gO3含有的氧原子数目为NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molAl与足量氢氧化钠溶液完全反应时失去的电子数目为3NA | |
| D. | 1mol•L-1K2CO3溶液中含有的钾离子数目为2NA |
| A. | 硫酸亚铁溶液 | B. | 氯化铝溶液 | C. | 硝酸银溶液 | D. | 氯化铁溶液 |
 Ⅰ.写出下列化学方程式:
Ⅰ.写出下列化学方程式: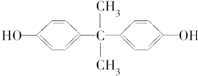 ).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题:
).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题: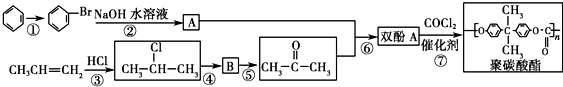
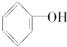 .
.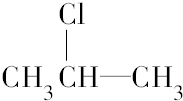 按系统命名法的名称为2-氯丙烷.
按系统命名法的名称为2-氯丙烷.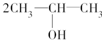 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O.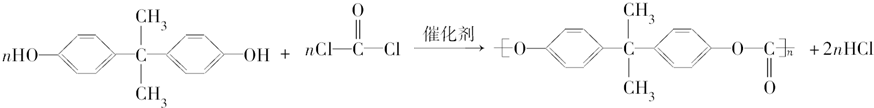 ,
,