题目内容
14.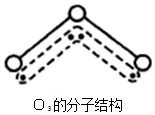 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:(1)选出下列分子与O3分子的结构最相似的是C.
A.H2OB.CO2C.SO2D.BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有5对孤对电子.
(3)O3分子是极性分子(填极性或非极性).
(4)O3能使淀粉碘化钾试纸变蓝2KI+O3+H2O═2KOH+I2+O2则氧化产物和还原产物的物质的量之比为1:2.
分析 (1)根据分子中中心原子的价层电子对数判断分子的空间构型;
(2)根据孤对电子的概念及臭氧分子结构分析;
(3)分子中正负电荷中心不重合,这样的分子为极性分子;分子中正负电荷的重心重合,则为非极性分子;
(4)氧化产物是碘,还原产物是氢氧化钾,由反应2KI+O3+H2O=2KOH+I2+O2计算.
解答 解:(1)O3分子的结构如图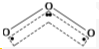 ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈V形;
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈V形;
A、H3O+中含有3对σ键,1对孤电子对,O原子sp3杂化,空间结构为三角锥形,故A错误;
B、CO2为含有4个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故B错误;
C、NO2-中O含有2个σ键,1对孤电子对,为sp2杂化,空间结构为V形,故C正确;
D、BeCl2含有2个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故D错误;
故答案为:C;
(2)中间的氧原子含有1对孤电子对,两边的各含有2对孤电子对,所以总共5对孤电子对,
故答案为:5;
(3)O3中的中心O原子为sp2杂化,理想模型为平面三角形,分子构型为V型,而且O3形成的是三中心四电子大π键,空间构型不对称.正负电荷重心不重合,所以是极性分子,故答案为:极性;
(4)氧化产物是碘,还原产物是氢氧化钾,由反应2KI+O3+H2O=2KOH+I2+O2可知,物质的量之比为1:2,
故答案为:1:2.
点评 本题考查了分子的结构及极性分子、同素异形体的判断,注重了基础知识的考查,难度中等.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
5.下列化学方程式或离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 乙醇与浓硫酸在140℃时共热:CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$ | |
| D. | 用18O标记的乙醇与乙酸发生酯化反应:C2H518OH+CH3COOH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O |
9.下列化合物中,既有离子键又有共价键的离子化合物是( )
| A. | NH4Cl | B. | MgO | C. | HNO3 | D. | CaCl2 |
19.下列冶炼金属的方法正确的是( )
| A. | 电解MgO制取Mg | |
| B. | 加热条件下用CO还原Ag2O制取Ag | |
| C. | 在A1和F2O3反应中,生成11.2gFe,转移电子数为0.6NA | |
| D. | 电解NaCl溶液制取Na |
6.下面是某同学做完铜一锌一硫酸原电池的实验后得出的结论和认识,正确的是( )
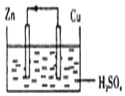

| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
3.化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A. | 在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀 | |
| B. | MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用热的纯碱溶液来除去物品表面的油污 |
 利用如图装置可验证同主族元素非金属性的变化规律.
利用如图装置可验证同主族元素非金属性的变化规律.