题目内容
为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙同学分别设计了如图一、图二所示的实验.
(1)H2O2分解的化学方程式为 .
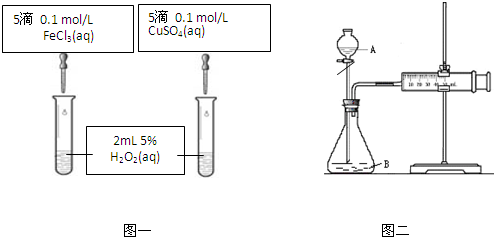
(2)图一所示实验能定性说明反应快慢的依据是 ;图二所示实验能说明反应快慢的数据是 .
(3)①用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39 kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46 kJ/mol
H2(g)+
O2(g)=H2O(l)△H=-285.84 kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+ 和H2O的热化学方程式为: .
②控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(1)H2O2分解的化学方程式为

(2)图一所示实验能定性说明反应快慢的依据是
(3)①用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39 kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46 kJ/mol
H2(g)+
| 1 |
| 2 |
在H2SO4溶液中Cu与H2O2反应生成Cu2+ 和H2O的热化学方程式为:
②控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3 mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)双氧水可以分解为水和氧气,据此确定方程式的书写;
(2)比较Fe3+和Cu2+对H2O2分解的催化效果,可以根据反应产生的气泡的速度来判断,还可以根据相等的时间内产生气体的体积大小来衡量;
(3)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②酸性环境下双氧水具有氧化性,能将金属铜氧化,但双氧水不稳定,温度高易分解.
(2)比较Fe3+和Cu2+对H2O2分解的催化效果,可以根据反应产生的气泡的速度来判断,还可以根据相等的时间内产生气体的体积大小来衡量;
(3)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②酸性环境下双氧水具有氧化性,能将金属铜氧化,但双氧水不稳定,温度高易分解.
解答:
解:(1)双氧水可以分解为水和氧气,即2H2O2
O2↑+2H2O,故答案为:2H2O2
O2↑+2H2O;
(2)比较Fe3+和Cu2+对H2O2分解的催化效果,可以根据反应产生的气泡的速度来判断,还可以根据相等的时间内产生气体的体积大小来衡量,图一可以根据反应中观察试管内气泡的速度(反应剧烈的程度)来得出结论,图二中,可以观察在相同时间内,注射器内产生的气体的体积(或收集相同体积气体所需时间)来得到结论,
故答案为:观察试管内气泡的速度(反应剧烈的程度);观察在相同时间内,图2注射器内产生的气体的体积(或收集相同体积气体所需时间);
(3)①a、Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
b、2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
c、H2(g)+
O2(g)═H2O(l)△H=-285.84kJ/mol,
由盖斯定律a+
b+c得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol,
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
②金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,但双氧水不稳定,温度高易分解,温度高于40℃时,双氧水分解速率加快,氧化铜的浓度就降低,所以铜的平均溶解速率随着反应温度升高而下降,
故答案为:H2O2分解而使其浓度降低,反应速率降低.
| ||
| ||
(2)比较Fe3+和Cu2+对H2O2分解的催化效果,可以根据反应产生的气泡的速度来判断,还可以根据相等的时间内产生气体的体积大小来衡量,图一可以根据反应中观察试管内气泡的速度(反应剧烈的程度)来得出结论,图二中,可以观察在相同时间内,注射器内产生的气体的体积(或收集相同体积气体所需时间)来得到结论,
故答案为:观察试管内气泡的速度(反应剧烈的程度);观察在相同时间内,图2注射器内产生的气体的体积(或收集相同体积气体所需时间);
(3)①a、Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
b、2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
c、H2(g)+
| 1 |
| 2 |
由盖斯定律a+
| 1 |
| 2 |
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
②金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,但双氧水不稳定,温度高易分解,温度高于40℃时,双氧水分解速率加快,氧化铜的浓度就降低,所以铜的平均溶解速率随着反应温度升高而下降,
故答案为:H2O2分解而使其浓度降低,反应速率降低.
点评:本题是一道实验方案的涉计探究题,考查学生实验的分析和综合能力,难度大.

练习册系列答案
相关题目
居室空气污染物达300多种,其中有一种来自人造地板、家具以及装修粘合剂,长期接触可引起过敏性皮炎、免疫功能异常.该污染物是( )
| A、甲醛(HCHO) |
| B、CO |
| C、氡(Rn) |
| D、NO2 |
下列物质中属于有机物的是( )
| A、甲醇 | B、苏打 | C、水泥 | D、玻璃 |


 已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.
 某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下: