题目内容
标况下,10mL某气态烃在50mL氧气里充分燃烧得到液态水和体积为35mL的混合气体(所有气体体积都是在同温同压下测定的),则该气态烃可能是( )
| A、甲烷 | B、乙烷 | C、丙烷 | D、丁炔 |
考点:有关有机物分子式确定的计算
专题:有机物分子组成通式的应用规律
分析:烃类物质碳原子个数一般小于4的为气体,令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,充分燃烧:CxHy+(x+
)O2
xCO2+
H2O,则x+
<5,根据方程式CxHy+(x+
)O2
xCO2+
H2O(l)利用体积差量计算判断.
| y |
| 4 |
| ||
| y |
| 2 |
| y |
| 4 |
| y |
| 4 |
| ||
| y |
| 2 |
解答:
解:令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,故烃完全燃烧,有氧气剩余,则x+
<5,
CxHy+(x+
)O2
xCO2+
H2O(l) 气体体积减小△V
1 1+
10mL 60mL-35mL=25mL
10mL:25mL=1:(1+
)
解得y=6,
由于x+
<5,所以x<3.5,故x=2或3,故为乙烷或丙烯,
故选:B.
| y |
| 4 |
CxHy+(x+
| y |
| 4 |
| ||
| y |
| 2 |
1 1+
| y |
| 4 |
10mL 60mL-35mL=25mL
10mL:25mL=1:(1+
| y |
| 4 |
解得y=6,
由于x+
| y |
| 4 |
故选:B.
点评:考查有机物分子式确定,难度中等,需要学生具备学生分析和解决问题的能力,根据原子守恒确定烃完全燃烧,氧气有剩余时根据,注意运用体积差的计算方法来解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
80年代中期,科学家发现并证明碳还以新的单质形态C60存在.后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子.90年代初,科学家又发现了管状碳分子和洋葱状碳分子(如图).下列说法错误的是( )


| A、金刚石和石墨的熔点肯定要比C60高 |
| B、据估计C60熔点比金刚石和石墨要高 |
| C、无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 |
| D、球碳分子是碳的同素异形体 |
下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
A、 甲烷分子结构示意图 |
B、 甲烷分子的电子式 |
C、 球棍模型 |
D、 比例模型 |
充分燃烧3L由甲烷、乙烯和丙炔组成的混合气体,生成7L CO2和4.82g水(气体体积均在标准状况下测定),则原混合气体中甲烷、乙烯和乙炔的体积比可能是( )
| A、1:1:1 |
| B、1:2:3 |
| C、3:2:1 |
| D、3:1:2 |
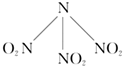 科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )| A、分子中的化学键有极性键和非极性键 |
| B、分子中四个氮原子位于正四面体的顶点 |
| C、该物质的熔、沸点可能比NH3高 |
| D、15.2g该物质含有6.02×1023个原子 |
下列物质在空气中露置容易变质的是( )
| A、NaCl |
| B、CaCO3 |
| C、NaOH |
| D、KNO3 |
下列有关氯气的叙述中正确的是( )
| A、氯气在常温下能与铁反应,故不能用铁罐存放液氯 |
| B、液氯和氯水不是同一物质 |
| C、点燃氢气和氯气的混合气体可以制取氯化氢 |
| D、用氯气对生活用水进行消毒的原因是氯气能杀灭细菌 |
下列关于有机化学实验的说法正确的是( )
A、实验室制取乙烯的反应原理:C2H5OH
| |||
| B、实验室制取C2H2,一般用碳化钙跟饱和食盐水反应以适度减缓反应速率 | |||
| C、实验室分离苯和苯酚的混合物,可采用溴水 | |||
| D、由1-溴丁烷跟氢氧化钠醇溶液共热,可以制得两种烯烃 |
下列叙述正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、含1mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l)H=-a kJ?mol-1 |
| C、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D、向Ba(OH)2溶液中加入足量的NaHCO3溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O |