题目内容
下列有关说法正确的是( )
| A、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H>0 |
| B、纯铁和生铁在酸雨中均发生电化学腐蚀 |
| C、2SO2(g)+O2(g)?2SO3 (g);△H<0,其他条件不变时加入催化剂,SO2的反应速率和平衡转化率均增大 |
| D、自发进行的反应一定能迅速进行 |
考点:焓变和熵变,金属的电化学腐蚀与防护,浓度、温度、催化剂对化学反应速率的影响
专题:
分析:A、△H-T△S>0的反应不能自发进行;
B、纯铁不能发生电化学腐蚀;
C、催化剂不影响平衡移动;
D、△G<0的反应能够自发进行,具体反应情况,还要看反应速率.
B、纯铁不能发生电化学腐蚀;
C、催化剂不影响平衡移动;
D、△G<0的反应能够自发进行,具体反应情况,还要看反应速率.
解答:
解:A、反应的△S>0,常温下不能自发进行,说明△H>0,故A正确;
B、纯铁中没有正极,不能发生电化学腐蚀,故B错误;
C、催化剂不影响平衡移动,不影响平衡转化率,故C错误;
D、△G<0反应自发进行,能否发生还有反应速率问题,故D错误;
故选A.
B、纯铁中没有正极,不能发生电化学腐蚀,故B错误;
C、催化剂不影响平衡移动,不影响平衡转化率,故C错误;
D、△G<0反应自发进行,能否发生还有反应速率问题,故D错误;
故选A.
点评:本题考查了反应自发进行的条件,注意利用△H-T△判断,题目难度不大.

练习册系列答案
相关题目
实验室中金属钠保存在煤油中,若将一小块金属钠露置于空气中发生一系列变化,最终产物是( )
| A、NaOH |
| B、Na2O |
| C、Na2O2 |
| D、Na2CO3 |
下列各组物质中,前者为强电解质,后者为弱电解质的是( )
| A、氯化钠,浓氨水 |
| B、氢氧化钠,水 |
| C、硫酸,硫酸钡 |
| D、氯化银,二氧化硫 |
在氧化还原反应中,氧化性强的物质能首先发生还原反应.已知氧化性Fe3+>Cu2+,现向含有0.1mol Fe2(SO4)3和0.2molCuCl2的某混合溶液中加入0.2molFe,充分反应后下列说法正确的是( )
| A、析出0.2molCu |
| B、剩余0.1molFe |
| C、没有金属析出 |
| D、剩余0.1mol的Cu2+ |
对于同质量的SO2和SO3,下列说法正确的是( )
| A、硫元素的质量之比为5:4 |
| B、分子数之比为1:1 |
| C、氧原子数之比为2:3 |
| D、体积之比为5:4 |
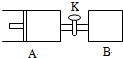 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=2PA |
| D、平衡时Y的体积分数:A<B |
