题目内容
下列各组物质中,前者为强电解质,后者为弱电解质的是( )
| A、氯化钠,浓氨水 |
| B、氢氧化钠,水 |
| C、硫酸,硫酸钡 |
| D、氯化银,二氧化硫 |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:在水溶液中完全电离的是强电解质;
在水溶液中部分电离的是弱电解质;
非电解质:在熔融状态和水溶液中都不能导电的化合物.
在水溶液中部分电离的是弱电解质;
非电解质:在熔融状态和水溶液中都不能导电的化合物.
解答:
解:A.氯化钠在水溶液中完全电离,是强电解质;浓氨水属于混合物即不属于强电解质也不属于弱电解质,故A错误;
B.氢氧化钠在水溶液中完全电离,是强电解质;水的部分电离,是弱电解质,故B正确;
C.硫酸在水溶液中完全电离,是强电解质;硫酸钡溶于水的部分完全电离,是强电解质,故C错误;
D.氯化银溶于水的部分完全电离,是强电解质;二氧化硫为非电解质,故D错误,
故选B.
B.氢氧化钠在水溶液中完全电离,是强电解质;水的部分电离,是弱电解质,故B正确;
C.硫酸在水溶液中完全电离,是强电解质;硫酸钡溶于水的部分完全电离,是强电解质,故C错误;
D.氯化银溶于水的部分完全电离,是强电解质;二氧化硫为非电解质,故D错误,
故选B.
点评:本题重点考查强弱电解质的判断,难度不大.要注意强电解质在水溶液中是完全电离的.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列反应中,属于取代反应的是( )
A、CH2=CH2+HCl
| |||
B、2CH3CHO+O2
| |||
C、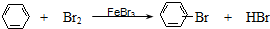 | |||
D、CH3CH2Br+NaOH
|
下列关于Na2O与Na2O2的说法中,错误的是( )
| A、两者颜色不同 |
| B、均可与H2O、CO2反应 |
| C、Na2O能被氧化成Na2O2 |
| D、它们的固体溶于水滴加酚酞试液后,现象相同 |
下列有关溶液组成的描述合理的是( )
| A、漂白粉的水溶液中大量存在:Fe2+、Cl-、Al3+、I- |
| B、强碱性溶液中可能大量存在:Na+、K+、S2-、[Al(OH)4]- |
| C、常温下pH=7的溶液中大量存在:SO42-、Na+、Cl-、Fe3+ |
| D、无色酸性溶液中可能大量存在:K+、CH3COO-、HCO3-、MnO4- |
如图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是( )


| A、Ⅰ极上铜放电而逐渐消耗 |
| B、电源a极为负极 |
| C、Ⅱ极上发生的电极反应为Fe-2e-═Fe2+ |
| D、Ⅱ极上Cu2+放电而使溶液中Cu2+浓度逐渐变小 |
下列有关说法正确的是( )
| A、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H>0 |
| B、纯铁和生铁在酸雨中均发生电化学腐蚀 |
| C、2SO2(g)+O2(g)?2SO3 (g);△H<0,其他条件不变时加入催化剂,SO2的反应速率和平衡转化率均增大 |
| D、自发进行的反应一定能迅速进行 |
两个体积相同的容器,一个盛有NO,一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的( )
| A、原子总数 | B、质子总数 |
| C、密度 | D、质量 |
化学兴趣小组设计如图实验装置.电解开始不久,铜电极附近溶液为无色,过了相当长时间后才呈蓝紫色.下列有关描述正确的是( )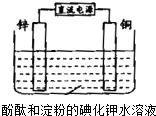

| A、电子由锌极流向铜极 |
| B、锌电极上的电极反应为:4OH--4e-═2H2O+O2↑ |
| C、铜电极实验现象的原因是生成的Cu2+和I-发生了反应 |
| D、将铜换成铁,电解开始后不久铁电极附近溶液即呈蓝紫色 |